
NEWS
新闻中心
SERVERS
服务项目
NEWS
最新资讯
发布时间:2021-03-16

文丨Yufei Xie, Annemarie H. Meijer and Marcel J. M. Schaaf*
翻译丨黄燕烽
发表于《Frontiers in Cell and Developmental Biology》January 2021 | Volume 8 | Article 620984
核心摘要 :
人类炎症反应的失调可导致各种炎症性疾病,如哮喘和类风湿性关节炎。免疫系统的先天分支,包括巨噬细胞和中性粒细胞的功能,在所有炎症性疾病中发挥关键作用。这部分免疫系统在人类和斑马鱼之间保存完好,斑马鱼已经成为一种强大的炎症动物模型,因为它提供了在生命早期的体内成像和研究炎症反应的可能性。
本文就斑马鱼体内建立的不同炎症模型及其在新型抗炎药物开发中的应用作一综述。常用的模型是尾鳍切除模型,将斑马鱼幼虫的尾鳍部分切除。该模型已被用于研究炎症反应的基础方面,如特定信号通路的作用、白细胞的迁移和不同免疫细胞之间的相互作用,也被用于筛选天然化合物、批准的药物和特征明确的途径抑制剂库。其他的炎症模型是由化学治疗引起的,如脂多糖(LPS)、白三烯B4(LTB4)和铜,而一些化学诱导的炎症模型,如三硝基苯磺酸(TNBS)治疗,特别是胃肠道炎症模型。
两种突变斑马鱼系携带了肝细胞生长因子激活抑制剂1a基因(hai1a)和cdp-二酰基甘油肌醇3-磷脂酰转移酶(cdipt)基因突变,显示了炎症表型,它们为研究炎症提供了有趣的模型系统。这些斑马鱼炎症模型经常被用来研究糖皮质激素的抗炎作用,以增加我们对这类药物作用机制的认识,开发新的糖皮质激素药物。本文就现有的斑马鱼炎症模型及其在揭示炎症反应的分子机制和筛选新型抗炎药物中的应用作一综述。
一、炎症和炎症性疾病
当机体受到有害刺激,如入侵的病原体、损伤或受损的细胞,免疫系统将被激活,并触发炎症反应。这种反应是由模式识别受体(PRRs)引起的,如toll样受体(TLRs)识别微生物特征分子的模式[病原体相关分子模式(PAMPs)],或受损细胞释放的分子[损伤相关分子模式(DAMPs)]。随后,免疫细胞释放促炎细胞因子,如IL-1β和TNF-α,这反过来刺激炎症介质的合成和释放,包括趋化因子和前列腺素。在趋化因子梯度的引导下,白细胞向炎症部位迁移,以处理受损组织或入侵微生物。这些分子水平上的变化将导致五个典型的炎症症状:热、痛、红、肿,并丧失功能。正常情况下,炎症过程通过相关细胞的功能重编程被积极终止,这导致恢复稳态。
在各种疾病中都可以观察到失调的炎症反应。异常和过度激活的炎症在炎症性疾病如哮喘、风湿性关节炎、过敏和自身免疫性疾病的发病机制中起着重要作用。胃肠道的慢性炎症可导致炎症性肠病(IBD),甚至可能导致非消化道并发症。此外,很明显,慢性炎症与一些以前被认为与炎症无关的疾病有关,包括癌症、2型糖尿病、神经退行性疾病和动脉粥样硬化。尽管炎症主要是对感染的有益防御反应,但众所周知,急性或慢性炎症反应过度激活会加剧感染性疾病病理,例如COVID-19和结核病。
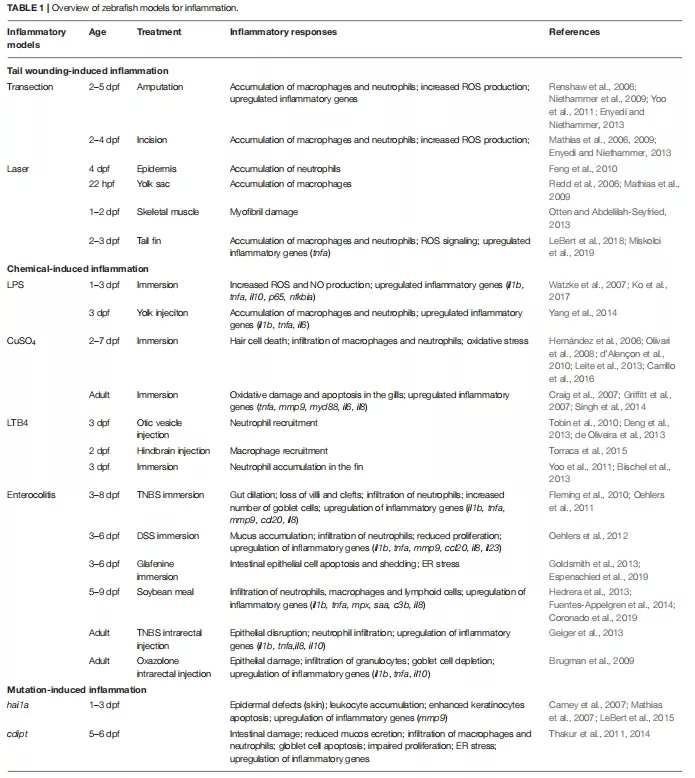
传统的炎症治疗方案包括使用类固醇[糖皮质激素(GC)]和非甾体类抗炎药物。然而,使用这些药物可能会引起多种副作用,包括骨质疏松、胃肠道紊乱、心脑血管事件和感染。在过去的几十年中,针对TNF-α,CD20或IL-6受体等靶标的单克隆抗体的成功应用极大地改善了炎性疾病(尤其是类风湿性关节炎)患者的预后。另外,已经发现了涉及NF-κB,p38 MAP激酶,T淋巴细胞活化和JAK / STAT的新型炎症信号通路抑制剂。尽管取得了显着进展,但仍未满足对更有效,更安全的消炎药的需求。在这次审查中,我们讨论了斑马鱼的有用的动物模型用于研究炎症mechanims并作为筛选系统accerelate研究,旨在新型抗炎药物的发现(综述呈现在表1,2) 。
二、斑马鱼作为生物医学研究的动物模型
利用斑马鱼(Daniorerio)作为研究模型始于20世纪50年代,初用于研究胚胎发育。斑马鱼是一种热带鱼,生长在淡水温度在24.6到38.6℃之间。当斑马鱼找到浅水海岸时,它们往往会在早上产卵,这很容易在实验室里模拟,用底部滑动的插入物和28℃的灯光。
斑马鱼的透明的胚胎和幼虫阶段,相对较短的生成时间,较小的尺寸和强大的繁殖能力使其成为一种用途广泛的动物模型。多年来,已经使用了遗传工具和实验方法,从而成功地对斑马鱼基因组进行了测序,从而能够快速筛选基因功能,并生成了各种用于研究人类疾病的转基因或突变鱼类和模型。由于对斑马鱼的知识积累和可用的工具,我们目前能够利用这个模型的优势。
尽管初用于研究胚胎发育,斑马鱼已成为多种生物医学研究领域的通用动物模型,包括免疫学、毒理学、癌症和行为生物学。近年来,已经有许多成功的尝试使用斑马鱼模拟人类疾病的尝试。例如,斑马鱼中发生的良性和恶性肿瘤的特征与人类肿瘤的组织学症状相似,感染了分枝杆菌的斑马鱼模拟了人类结核病的特征,并且斑马鱼的表型在Sauternes基因中携带突变,非常类似于人类X连锁的先天性铁粒幼细胞性贫血的病理学。在这篇综述中,我们将讨论斑马鱼如何用作炎症性疾病的动物模型,以及如何将可用的模型用于抗炎药的研究。
该模型的一个重要优点是斑马鱼胚胎体积小,自动化技术的发展有利于高通量筛选。虽然线虫和果蝇也经常用于高通量筛选,但它们的角质层可能是扩散的障碍。斑马鱼胚胎没有角质层,因此,大多数药物可以通过简单地将它们添加到培养液中相对较低的剂量。作为一种脊椎动物,相较于蠕虫和苍蝇,斑马鱼在进化上更接近于哺乳动物,所以结果更容易推断到人类。
因此,斑马鱼模型有很强的潜力作为在药物开发过程中用于临床前生物测定的全动物模型。除了应用斑马鱼来测试药物在特定疾病模型中的疗效外,它们是也常用于测试候选药物的毒性。目前存在标准化的毒性试验,例如鱼类胚胎急性毒性试验(FET),经济合作与发展组织(2013年)已公布了该试验的准则。除了这些以死亡率和明显形态变化为终点的一般毒性测定方法外,还有更专门的测定方法,如生殖毒性、肝毒性、肾毒性、心脏毒性和评估药物滥用责任。
斑马鱼的免疫系统与人类的非常相似。在斑马鱼发育过程中,免疫系统的先天分支首先成熟,巨噬细胞可以在受精后15小时观察到。通过以26 hpf的速度开始血液循环,胚胎巨噬细胞已经能够吞噬颗粒,产生活性氧(ROS)并杀死病原体。斑马鱼嗜中性粒细胞的发育速度为18 hpf,成熟时间为24至48 hpf,就人类的中性粒细胞而言,类似于核分裂,颗粒和髓过氧化物酶的表达。
此外,斑马鱼显示出适应性免疫系统的保守关键部分,包括胸腺发育,胸腺细胞发育以及T细胞和B细胞的功能。适应性免疫系统在3到4周后成熟,这意味着可以在胚胎早期和幼体阶段分别研究先天免疫系统。还发现斑马鱼的炎症反应保存良好,已被成功用于增强我们对嗜中性粒细胞在炎症疾病中作用的机理的认识。斑马鱼幼虫的炎症反应可以使用多种方法诱导。在本文中,我们概述了引发炎症的不同方法(有关这些不同方法的示意图,请参见图2),并讨论如何将它们用于研究炎症反应的分子机制以及研究目的,在开发新型抗炎药,尤其是新型GC药物方面。
三、机械损伤性炎症
通过尾伤人诱导的急性炎症是用于在斑马鱼中的炎症和再生研究(一个完善的模型图1,图2A)。
可以通过截去尾鳍的一部分或在立体显微镜下用无菌手术刀或针切开鳍来进行尾巴受伤,这可以在斑马鱼的胚胎,幼虫和成虫中进行。在胚胎(高达72 hpf的阶段)和幼虫(72 hpf以上的阶段)中,截肢可能包括脊索的远端,以诱导更强的反应(图1A)。
随后,可以观察到急性局部炎性反应,引起伤口区域附近巨噬细胞和中性粒细胞的积累。通过使用转基因鱼可以实现白细胞的可视化,在转基因鱼中,自发荧光蛋白(例如GFP和mCherry)的表达是由在嗜中性粒细胞中有特异性活性的启动子(例如髓过氧化物酶(mpx))驱动的和溶菌酶(lyz)启动子,或巨噬细胞中(例如巨噬细胞表达的gene-1(mpeg-1)和mfap4启动子或通过标记这两种细胞类型的启动子和pu.1。除直接横切外,还可通过激光照射躯干上的表皮,卵黄囊,骨骼肌组织,或卵黄囊上方的黑素细胞和尾部造血组织(CHT)。
灼烧笔对尾鳍造成的热损伤已显示导致伤口区域胶原纤维的大量损失(与尾鳍横断不同),伴随着强烈的炎症反应和延迟的再生尾横切后。应该注意的是,胚胎和幼虫的尾鳍不是血管化的组织,许多新募集的白细胞从附近的组织(例如CHT)迁移到伤口。因此,这些模型大多不考虑白细胞的血管内迁移。
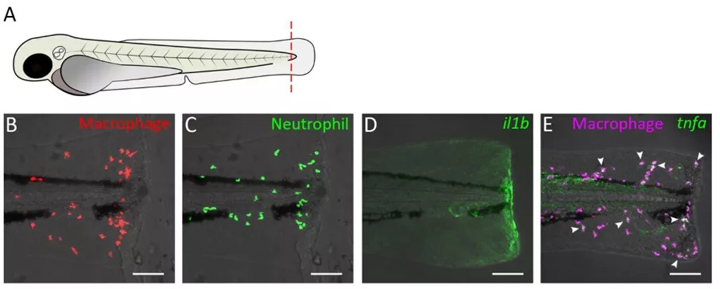
图1 斑马鱼幼虫尾部横切面作为炎症模型。(A)斑马鱼幼虫3dpf的示意图。红色虚线表示横断部位(在一些研究中,横断部位可能不包括脊索的a部分)。(中)的共焦显微镜图像尾切除幼虫的转基因线:Tg(mpeg1:mcherry-F)(B),Tg(mpx:GFP)(C)、Tg(il1b:GFP)(D)、Tg(mpeg1:mcherry-F/tnfa:eGFP-F)(E)。图像拍摄4hpost-amputation使用EclipseTi-E尼康显微镜计划7月20x/0.75NA的目标。图像显示伤口附近巨噬细胞中巨噬细胞(B)和中性粒细胞(C)聚集,il1b基因激活(D),tnfa表达(E)。在(E)中,箭头表示tnfa被激活的巨噬细胞。
四、炎症反应的分子机制研究
使用斑马鱼尾巴受伤模型进行炎症反应,已经阐明了炎症反应的不同分子途径。作为损伤的反应,受损的上皮细胞产生持续的过氧化氢[H2O2通过局部激活上皮NADPH氧化酶Duox。这种梯度启动白细胞招募到损伤区域,特别是中性粒细胞,中性粒细胞使用Src家族激酶Lyn作为氧化还原传感器检测H2O2梯度。
此外,上皮细胞已被证明利用脂肪酸β-氧化来增加其线粒体ROS的产生,以应对损伤。这一过程需要哺乳动物线粒体酶,免疫应答基因1(IRG1)的斑马鱼同源物的活性,并被证明有助于中性粒细胞募集(Hall等,2013,2014a)。
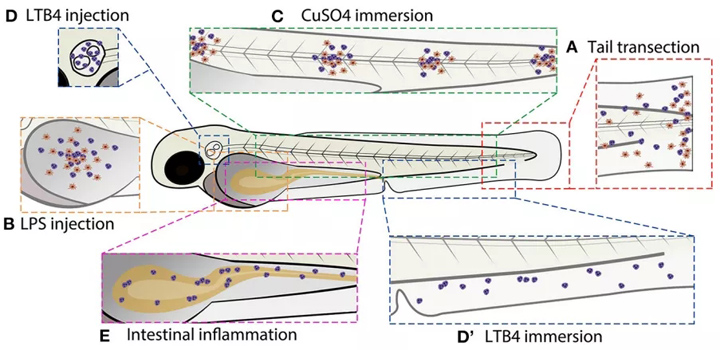
图2 常用斑马鱼幼虫炎症模型示意图(A)横切尾鳍。(B)卵黄囊内注射LPS。(C)浸入CuSO4对神经母细胞造成损伤。(D)耳泡注射LTB4。(D)LTB4浸。(E)化学物质引起的肠道炎症。所有的模型都能诱导白细胞募集。红细胞代表巨噬细胞,紫色细胞代表中性粒细胞(在一些模型中,巨噬细胞浸润未显示,因为在本文引用的研究中未进行研究)。另一种斑马鱼幼虫炎症模型,在本文中讨论,但在本图中没有展示,包括激光损伤、尾鳍切口、LPS浸泡和突变诱导的炎症。尾鳍横切/切开、CuSO4浸泡和肠道炎症模型均采用成年斑马鱼。
在嗜中性粒细胞中,发现磷酸肌醇3-激酶(PI3K)通过诱导肌动蛋白聚合并通过Rac活化和F-肌动蛋白动力学极化(以独立于Rac的方式)极化在前沿产生膜突出来介导迁移。肌动球蛋白介导的尾巴收缩。用微管不稳定药物诺卡多唑进行的治疗会损害中性粒细胞向伤口的迁移,即使该过程增强了F-肌动蛋白动力学的极性。SHIP磷酸酶可能通过抑制PI3K活性来限制中性粒细胞的迁移及其向伤口的迁移。中性粒细胞的迁移似乎也需要维斯科特-奥尔德里奇综合症蛋白(WASp)才能发挥其正常的迁徙行为。
巨噬细胞通过假足的延伸迁移到损伤区域,并能够吞噬组织碎片(Mathiasetal.,2009)。Nocadozole引起的微管拆卸通过Rho激酶(ROK)的整体活化抑制了巨噬细胞向伤口的迁移,从而丧失了ROK活性的极性。使用Tg(tnfa:GFP)报告基因系鉴定出斑马鱼巨噬细胞的两个不同子集,类似于哺乳动物巨噬细胞中观察到的分化过程。GFP阳性巨噬细胞在伤后1小时就已经观察到,它们的特征是扁平和小叶的形态,以及经典激活的促炎性(M1)巨噬细胞特征性标志物的表达。那些GFP阳性巨噬细胞可以转化为阴性,在后期占优势,显示出交替激活的抗炎(M2)巨噬细胞的特征。
尾巴损伤后白细胞的迁移依赖于新生蛋白合成,因为蛋白合成抑制剂环己酰亚胺的治疗被证明可以抑制中性粒细胞和巨噬细胞的迁移。AP-1和NF-κb诱导的转录已被证明参与,这些转录因子复合物的作用受到MAP激酶(MAPK)活性的高度调控。一类MAPKs,c-Junn端激酶(JNKs),参与调控AP-1诱导的转录,而另一类,p38MAPKs,似乎并没有改变AP-1的功能。损伤时,活化的JNKs激活c-Jun,进而诱导中性粒细胞中mmp13的转录,这是这些细胞迁移所必需的。JNK/c-Jun/Mmp13通路可被Mkp-1抑制(Zhangetal.,2008)。此外,JNK介导的c-Jun激活导致编码5-脂氧合成酶alox5基因的表达增加,这是参与白三烯生物合成的关键酶,包括LTB4。该通路也被证明是尾部损伤时中性粒细胞迁移所必需的,并可被2型大麻素受体(Cnr2)的激活所抑制。NF-κB的激活,以p65磷酸化为特征,被证明依赖于另一个磷酸化MAPKs类,细胞外信号调节激酶(ERKs)。该通路的激活被证明依赖于生理周期基因period1b(per1b),并导致tnfa、il1b、il6和il8等促炎分子的表达增加(Renetal.,2018)。
已知细胞因子IL-8(或CXCL8)是哺乳动物系统中对中性粒细胞有效的趋化剂。斑马鱼的同源基因Cxcl8a(Cxcl8-l1)和Cxcl8b。1(Cxcl8-l2)已被证明在尾部损伤时上调,通过Cxcr2介导中性粒细胞募集。趋化因子Ccl2和Cxcl11aa通过敲低编码其各自受体Ccr2和Cxcr3.2的基因表达被证明是创伤诱导巨噬细胞迁移所必需的。抑制细胞因子IL-1β的激活(通过caspase-1抑制剂和P2X7拮抗剂)导致中性粒细胞和巨噬细胞的迁移减弱。
此外,在两项研究中,morpholino治疗中Il-1β基因的敲除被证明可以减少中性粒细胞向损伤区域的迁移(尽管Il-1β在随机基础运动中似乎是不可缺少的)。在一项研究中,巨噬细胞的迁移不受il1bmorpholino敲低的影响,而在另一项研究中,巨噬细胞的迁移减少的il-1β通路(也包括适配器MyD88蛋白)展示了独立行动的NADPHoxidase-mediatedROS生产,因为治疗NADPH氧化酶抑制剂DPI并不影响il1b表达水平(反之亦然:il1b和MyD88击倒并不影响ROS生产在尾巴受伤)。
受伤后数小时,反应进入消退期,并且有人提出活跃的Wnt /β-catenin信号传导在这种转变中起作用。在炎症反应的缓解阶段,中性粒细胞离开受伤区域(称为反向迁移的过程)或发生凋亡。中性粒细胞的存活受到血清和糖皮质激素调节激酶1(SGK1)的调控,SGK1是中性粒细胞存活因子GM-CSF下游的抗凋亡蛋白。缺氧诱导因子-1α(HIF-1α)已被证明是调节哺乳动物髓细胞功能的关键因子,Hif-1α的激活通过抑制中性粒细胞的凋亡和逆转而延迟了斑马鱼炎症的消退、迁移,发现反向迁移的中性粒细胞表现出活化的形态并正常响应于诸如局部细菌感染的继发性攻击。
在研究中,显示了中性粒细胞从伤口向次级细菌感染基因座的反向迁移在Hif-1α激活后得以减慢。Cxcl12 / Cxcr4信号转导轴在嗜中性粒细胞保留和敲除cxcr4b和cxcl12a或对该信号的药理学抑制作用增加了嗜中性粒细胞从受伤区域的运动。
最近,共生菌群被证明可以调节斑马鱼的先天免疫力和炎症反应,不同的细菌具有不同的作用。斑马鱼的早期暴露于共生微生物引发了中性粒细胞,并诱导了几种编码促炎和抗病毒介质的基因。尾巴受伤后,在微生物群克隆的斑马鱼中观察到嗜中性粒细胞的募集增加。共生微生物对嗜中性粒细胞的这种启动作用似乎是通过Tlr / Myd88信号传导途径介导的,并且中性粒细胞迁移的增加需要诱导急性期蛋白血清淀粉样蛋白A(Saa)。已证明,Saa的这种作用是由NF-κB依赖性基因表达介导的。
此外,肠道中的微生物(丁酸)产生的短链脂肪酸可减少嗜中性粒细胞通过羟基羧酸受体1(Hcar1)依赖性途径向伤口的迁移,并减少M1巨噬细胞的募集,而与Hcar1。对于再生研究,通常在受精(dpf)斑马鱼后2天进行截肢,此后可以逐渐观察到组织修复,并在3天后以5 dpf建立完全再生,这在许多国家(包括欧盟规定的时间范围内,动物实验规定不适用。已证明斑马鱼胚胎的组织再生取决于伤口边缘处ROS诱导波形蛋白的产生,并且Stat3和Tgfβ信号通路参与了该过程。
此外,已经表明,使用pu.1 / spi1b基因的吗啉代敲除,巨噬细胞和嗜中性粒细胞消融后的再生不受影响,该基因编码允许髓样细胞发育所需的转录因子。
但是,在以后的研究中,巨噬细胞被证明对细胞增殖和组织再生至关重要,因为irf8吗啉代(驱动髓样细胞命运向中性粒细胞发育)消融巨噬细胞会导致鳍再生受损,并存在较大的液泡在再生组织中。特定的巨噬细胞亚群,即外周组织驻留巨噬细胞,通过ROS的产生和受损部位炎症介质如Il-1β的下调,促进了尾鳍的再生。
在成年斑马鱼尾鳍截肢模型中,巨噬细胞还显示出通过调节组织生长和骨射线模式来增强尾鳍再生,这通过使用硝基还原酶(NTR)/甲硝唑(MTZ)消耗转基因鱼中的巨噬细胞来证明。细胞消融技术。runx1基因的突变可减少中性粒细胞数量,但不影响尾鳍的再生。这些发现表明,由伤口引起的炎性反应,特别是巨噬细胞的募集,对组织修复和再生至关重要。
五、药物发现研究
斑马鱼尾部损伤引起的炎症已经被大量研究用于抗炎药物的测试和筛选。在此模型系统中,对天然化合物、表征良好的药物和明确的通路抑制剂进行了测试,并筛选了这些化合物的几个库。这些研究有助于验证这一炎症模型,并鉴定了一些新的抗炎化合物,需要在其他模型中验证,并进一步优化和测试。
为了寻找新的抗炎药物从现有的集合或临床批准药物,批准药物的图书馆,以前从未被描述为抗炎化合物筛选的能力抑制中性粒细胞招募的斑马鱼的尾巴受伤化验。
有趣的是,从斑马鱼筛选中筛选出的10种有效的药物(包括盐酸阿莫地喹、盐酸阿弗佐新和盐酸可乐定)在皮肤炎症小鼠模型中也显示出抗炎活性。为了发现现有药物的新类似物,并减少副作用,我们使用斑马鱼尾部损伤模型筛选了几种沙利度胺类似物。许多类似物被证明可导致中性粒细胞招募减少,而不会出现原药物臭名昭著的致畸性副作用。通过筛选斑马鱼尾鳍损伤模型中的激酶抑制剂,确定了加速炎症分解的重要药物靶点erbb(Rahmanetal.,2019)。通过筛选斑马鱼尾鳍受伤模型中的激酶抑制剂,鉴定出了加速炎症消退的重要药物靶标ErbBs。ErbB抑制剂和两个同时编码ErbB激酶的基因的基因敲除(egfra和erbb2)导致嗜中性粒细胞凋亡受到抑制,并降低了斑马鱼幼虫的炎症水平。
此外,已经使用该模型进行了结构功能研究。例如,发现靛蓝素的衍生物meisoindigo,它是中草药清代的化学成分,可抑制因尾巴受伤而引起的白细胞迁移,而不会影响逆向迁移或Akt和Erk活性,而靛蓝素(代表核心meisoindigo的结构)没有显示任何作用。此外,发现在四个分子中存在一个特定的化学基团,该化学基团由稠合的苯和吡喃环以及一个相连的羰基(1,4-苯并吡喃酮)或其异构体“香豆素”(1-苯并吡喃-2-酮)组成。在2,000种经过充分表征和批准的药物的大屏幕中,鉴定出了九种有效的前拆分化合物。所有这四种药物均加速了炎症的消退,其中三种还抑制了中性粒细胞向伤口的迁移。其他含有这种苯并吡喃酮结构的化合物也显示出相似的作用,活跃的一种是异海洛平(通过抑制PI3K)抑制白细胞募集,并促进分离期(通过诱导嗜中性白细胞凋亡)。
天然化合物库是药物发现的丰富资源。各种天然产物已被证明对伤口区域附近的白细胞浸润具有抑制作用,包括药用人参的提取物(人参属植物的根,例如人参)。这些提取物中的一种生物活性化合物被证明是人参皂苷Rg1,这是一种糖基化的类固醇,通过糖皮质激素受体(GR)发挥其抗炎活性。使用真菌提取物文库,发现两种化合物sterostertocystin和抗生素PF1052抑制中性粒细胞募集。
对于百里香(Symus vulgaris)的精油,从无花果(Ficus hirta)根分离出的香豆素衍生的bergapten,超温热的超氧化物歧化酶(S. (Thermus thermophilus HB27(TtSOD),用于从绿色海藻半枝藻(Cymopolia barbata)及其主要活性成分cymopol中提取(Bousquet et al。,2020),以及从Micromelum分离的化合物micrometam C.景天树,是红树林的伴生。在尾部定叶试验中发现了长叶鸢尾(Clerodendrum cyrthophyllum Turcz)叶提取物的各种促炎基因表达下调和抗炎基因il10上调。从红海藻Laurencia快餐中分离出的代谢产物5β-HydroxypalisadinB,bergapten和多糖岩藻依聚糖,提取自棕色海藻Ecklonia cava。后两种化合物还通过抑制一氧化氮(NO)的合成而减弱了炎症反应,而一氧化氮是重要的炎症介质。丹参酮IIA证明是通过促进中性粒细胞凋亡和逆向迁移来增强炎症反应的解决方法,丹参酮IIA是从丹参丹参中提取的一种化合物。
六、化学诱导炎症
1. LPS诱发炎症
脂多糖(LPS)是革兰氏阴性细菌细胞壁中的一种内毒素,作为一种PAMP,在被TLRs识别后诱导先天免疫反应。LPS引起的斑马鱼炎症通常是通过将胚胎非侵入性地浸入含有LPS的卵培养基或注射入蛋黄。在哺乳动物中,对LPS的免疫反应的特征在于TLR4介导的NF-κB诱导和各种炎症介质(包括TNFα和IL-1)的表达。然而,由于识别的细胞外结构不同以及缺乏必需的共刺激分子,斑马鱼中鉴定的TLR4旁系同源物不能识别LPS。
尽管LPS的识别机制尚不明确,但已经观察到一种类似于在哺乳动物中观察到的反应,表明两者之间存在高度的保守性。斑马鱼和哺乳动物响应LPS刺激的转录因子和信号通路。LPS刺激增强NO和ROS的产生,增加iNos和Cox2蛋白的水平,以及p65、nfkbiaa和其他编码重要促炎细胞因子包括tnfa和il1b的基因的mRNA水平。用亚致死剂量的LPS预处理斑马鱼可以防止随后致死剂量的LPS导致的死亡,这表明通常在哺乳动物中观察到的耐受性可以在斑马鱼中重现。Cxcr4信号通路似乎在脂多糖耐受的发生中发挥了重要作用。
脂多糖诱导的斑马鱼炎症已被用作抗炎药物研究的模型。利用该模型对传统中药和非中药的许多化合物和提取物进行了实验,其中一些化合物对LPS注射引起的炎症有抑制作用。绿原酸是一种多酚类化合物,存在于咖啡和连翘果实的主要成分连翘苷中,它抑制巨噬细胞和中性粒细胞向注射LPS的部位募集,提高存活率。后者通过降低编码IκBα、Il-1β、Il-6和Tnf-α的基因表达水平抑制MyD88/NF-κB信号通路。蜡梅提取物。叶子也抑制了中性粒细胞(而不是巨噬细胞)的募集,减少了lps诱导的il1b、il6和tnfa表达的上调。蛋白TtSOD,抑制尾部损伤诱导的中性粒细胞迁移,也被证明在LPS注射时抑制中性粒细胞浸润。
在许多研究中,ROS和/或NO的产生已被用作抗炎作用的读数。polyphyllapolyphylla的PolyphyllinVII(PP7)抑制NO的生成,LPS注入卵黄囊后也可导致心跳死亡,减轻卵黄囊水肿。岩藻糖胶和从鹰钩藤中提取的富含多酚的部分抑制NO和ROS的形成,就像化合物5β-羟基沙丁B,也被证明在尾部损伤模型中具有抗炎作用。从鹰爪花中提取的富含多酚的部分也能减少细胞死亡和提高存活率。在一些报道中,只有没有一代被用作药物的抗炎效果的指标,这被用来证明咖啡因的影响和oleuropein,酚类化合物存在于橄榄和橄榄树的叶子。
载脂蛋白(apo)AI是高密度脂蛋白(HDL)的主要成分之一,已显示具有抗炎作用。通过共注射含有天然或糖基化apoA-I的LPS和HDL,在斑马鱼胚胎中测试了apoA-I修饰的作用。结果表明,注射HDL天然apoA-I可以降低死亡率,这可能是由于其具有抗炎作用。
LPS处理也已与尾巴伤痕结合使用,以增强伤口附近的白细胞积聚。该模型用于评估的东非药用植物,的结构不同的天然产物的生物活性鹿霍属VISCOSA,产生具有抗炎活性的已知的和新的异黄酮衍生物的鉴定。
2. 硫酸铜诱发炎症
铜是一种微量元素,对各种参与能量和抗氧化代谢的酶起催化辅因子作用。环境中过量的无机铜会破坏斑马鱼体内的铜平衡,导致氧化应激损伤介导的炎症反应。据报道,在成人中,可溶性铜可诱导鱼鳃的氧化损伤和凋亡,并显示出剂量依赖的致命性。在硫酸铜(CuSO4)治疗后,肾骨髓中的中性粒细胞被激活,对中性粒细胞的蛋白质组分析显示,中性粒细胞参与细胞周期的蛋白调节、NO信号传导、细胞骨架调节和免疫相关过程。
据报道,斑马鱼胚胎暴露于CuSO 4会抑制胚胎的存活和发育。它诱导炎症状态,与加剧的损伤和氧化应激有关,并且内源性信号分子腺苷被证明参与其中。重要的是,这种治疗会在2小时内诱发侧线神经瘤中毛细胞的死亡,并在1天后再生并达到全部功能。对神经瘤的这种损害导致神经瘤中局部的强烈炎症反应,包括巨噬细胞和中性粒细胞的浸润(图2C)。募集的巨噬细胞在受损毛细胞的再生中起关键作用,因为消融巨噬细胞会显着延迟该过程,而不需要嗜中性白细胞。
中性粒细胞在神经节中的蓄积是该模型中炎症水平常用的指标之一,已被用于评估已知抗炎药的作用。由于仅通过将化合物添加到培养基中就可以建立由CuSO 4引起的炎症诱导,因此可以使用该模型基于中性粒细胞的双转基因系,基于神经浆周围白细胞的积累,利用该模型开发一种自动化的高通量药物筛选测定方法标记为红色,神经质标记为绿色[使用claudin b(cldnb)启动子驱动GFP表达]。使用该自动化系统,从临床批准的药物库中鉴定出多种药物具有抗炎作用,其中包括NOS1抑制剂3-Bromo-7-nitroindazole。进一步的研究表明,NO信号通过可溶性鸟苷酸环化酶和在可溶性鸟苷酸环化酶中以非依赖性方式(通过蛋白质S-亚硝基化)具有新型的促炎作用。
此外,据报道,已知一种神经肽,垂体腺苷酸环化酶激活多肽(PACAP)-38可抑制中性粒细胞向神经母细胞的迁移和促炎基因的表达(il8,il1b ,il6和atf3)。据报道,几种天然产物对CuSO 4诱导的中性粒细胞积累具有抑制作用,包括从山茱sorb的根中提取的新萜糖苷,skip鱼的酶促肽(SEP)(Katsuwonus pelamis)和Qu州F子的提取物,这是一种来自苦橙树的未成熟果实(芸苔科柑橘常山-火友YB Chang)。化合物PP7(购自Paris polyphylla)和TtSOD也表现出对CuSO 4刺激后嗜中性白细胞迁移的抑制作用,类似于在LPS中观察到的这些化合物诱导的炎症模型。Clerodendrum cyrtophyllum Turcz叶片的提取物通过下调与炎症过程相关的基因来降低CuSO 4诱导的氧化应激并抑制炎症(cox2,pla2,c3a,mpx)和细胞因子(il1b,il] 8,tnfa和il10)。
3. LTB4诱发炎症
白三烯B4(LeukotrieneB4,LTB4)是一种白细胞释放的二十烷类化合物,作为促炎症介质,增强炎症部位的白细胞积累。
在斑马鱼中,LTB4被证明能够同时吸引中性粒细胞和巨噬细胞。将LTB4注射到3dpf斑马鱼幼虫的耳泡中,在注射后1小时观察到中性粒细胞向耳的募集,这种募集并不依赖于Cxcl8/Cxcr2信号(图2d)。
此外,后脑注射30hpf的LTB4可招募不依赖Cxcl11aa/Cxcr3.2信号通路的巨噬细胞。浴法应用LTB4可诱导中性粒细胞向鳍内扩散,可通过计数腹鳍细胞来定量(图2D’)。抑制Cxcl8/Cxcr2信号通路或DPI或Lyn敲低均不能阻止这种ltb4诱导的中性粒细胞迁移,设计了一种限制性阵列(ZEBRA)诱捕斑马鱼微流控装置,用于快速定位斑马鱼胚胎和幼虫在可预测阵列中,适合于自动成像。
通过评估PI3K抑制剂LY294002对ltb4诱导的中性粒细胞迁移的抑制作用,验证了该装置的有效性。该设备可以设计成具有可进行治疗的进入端口,并且也有可能用于其他炎症分析,例如尾巴受伤。
4. 化学诱导肠道炎症
炎症性肠病(IBD)是一组以消化道炎症为特征的肠道疾病。在斑马鱼身上模拟了炎症性肠病,方法是用诱导类炎症性肠病的化学物质处理鱼小肠结肠炎(图2e)。
据报道,成年斑马鱼直肠内注射半抗原oxazolone可诱导小肠结肠炎,其特征是粒细胞浸润、上皮细胞损伤、杯状细胞耗损以及编码细胞因子的基因表达上调(il1b、tnfa、il-10)。在成年斑马鱼直肠内给药另一种半抗原——三硝基苯磺酸(TNBS)也得到了类似的结果,该蛋白也显示出增加了黑色素浓缩激素(Mch)的肠道mRNA和肽水平以及编码其受体的mRNA水平。
将幼虫浸泡在含有3-8dpfTNBS的蛋水中可诱导肠道炎症反应。使用荧光染料,被鱼吞下,可以评估肠道结构和运动,显示tnbs诱导的肠道扩张,绒毛长度减少,隐窝扩张和蠕动减少。在整个肠道中,组织学分析显示管腔扩张,没有绒毛和裂隙的肠道内壁光滑,杯状细胞数量增加。在另一项使用不同剂量和时间的TNBS暴露的研究中,未观察到报道的肠细胞形态学变化。本研究观察到,在TNBS治疗后,炎症肠道中性粒细胞数量增加,il1b、tnfa、mmp9、ccl20和il8表达增加。
斑马鱼幼虫暴露于洗涤剂右旋糖酐硫酸钠(DSS)也可诱导肠道炎症。该治疗概述了tnbs诱导的小肠结肠炎的几个方面,诱导症状如促炎基因表达升高和肠道周围中性粒细胞聚集。然而,炎症表型与TNBS诱导的并不相同,DSS治疗实际上可以预防TNBS诱导的小肠结肠炎。非甾体抗炎药glafenine也被用于斑马鱼幼虫暴露12h后诱导肠道损伤,其特征是深刻的肠道特异性病变。Glafenine可诱导肠上皮细胞凋亡和脱落,这是内质网应激和未折叠蛋白反应的诱导引起的。glafenine对多药耐药(MDR)外排泵的抑制作用在肠上皮细胞脱落过程中起重要作用。这种脱落通过限制炎症和促进生存发挥保护作用。
此外,大豆粉通常被用作水产养殖中的替代鱼粉,作为鱼粉中蛋白质的来源,已被证明可引起斑马鱼幼虫的肠道炎症。这种炎症反应的特征是嗜中性白细胞募集到肠道和增加编码促炎细胞因子(il1b和il8)的基因的转录水平,并且被证明是由大豆皂素而不是大豆蛋白引起的。在后来的研究中,大豆皂苷和分离蛋白均显示出增加了肠道中性粒细胞的数量(使用苏丹黑染色)以及与先天免疫系统相关的基因(il1b,tnfa,mpx,saa和mpx,saa)的表达。,c3b)。
此外,炎症显示增加上皮通透性,减少蛋白质吸收并改变肠道菌群的组成。豆粕诱导的肠道炎症取决于肠内存在的淋巴样细胞的存在,这些淋巴样细胞对应于具有Th17转录特征的T辅助细胞。当着眼于长期影响时,发现豆粕或大豆蛋白的早期喂养对幼年期的炎症具有编程作用。由于豆粕是鱼类重要的商业食品来源,因此已经进行了研究以鉴定可补偿其促炎作用的添加剂,并且显示出一些候选物可抑制豆粕触发的肠道炎症,包括乳铁蛋白,微藻类,芦荟,典型的胆碱酯酶抑制剂加兰他敏和产生枯草杆菌的枯草芽孢杆菌菌株。
就像在患有IBD的人类和IBD的小鼠模型中一样,肠道微生物群的可变组成被证明是斑马鱼肠道炎症的重要决定因素(豆粕诱导的肠道除外)炎症]。用万古霉素或硫酸粘菌素硫酸盐处理成年斑马鱼对肠道菌群的组成有不同的影响,这影响了恶唑酮诱导的小肠结肠炎的严重程度和肠道白细胞浸润的组成。
在幼虫中,用广谱抗生素卡那霉素和氨苄青霉素治疗会导致微生物群的严重丧失,TNBS暴露后死亡率降低,并抑制促炎性基因表达的诱导和白细胞向肠道的迁移。使用产生无菌斑马鱼幼虫的方案,证实了TNBS诱导的病理学,包括组织学变化和编码促炎性细胞因子的基因表达增加,完全取决于驻留的微生物群。TNBS诱导的幼虫小肠结肠炎增加了变形杆菌(特别是伯克霍尔德氏菌)的比例)并减少了幼虫菌群组成中Firmicutes(乳酸杆菌组)的相对数量,这些变化与小肠结肠炎的严重程度有关。
与线虫Anisakis的排泄分泌产物共同处理表明,成年斑马鱼抑制了TNBS诱导的死亡率和促炎基因表达,这表明暴露于寄生性蠕虫的免疫调节作用下可以预防IBD。观察到一种特定的血浆脂肪酸棕榈酸加剧了斑马鱼幼虫中TNBS诱导的小肠结肠炎,表明脂肪酸可以调节肠道炎症,这与源自人类荟萃分析的假设相符。全基因组关联研究。
使用已知的(甾体和非甾体)抗炎和抗生素药物治疗进一步减轻对TNBS的反应,进一步验证幼虫TNBS诱导的小肠结肠炎模型。也使用该模型进行了小规模的药物筛选,其中测试了NOS抑制剂以及沙利度胺和小白菊内酯。沙利度胺和单烯酚内酯显示TNF-α表达降低(基于免疫组织化学),通过组织学分析评估,只有NOS抑制剂可以挽救体内疾病表型。嗜热栖热菌的超热超氧化物歧化酶HB27还显示出可减少TNBS诱导的肠道肿胀和中性粒细胞浸润。
同样,通过证明视黄酸(RA)在抑制病理性肠粘蛋白产生中的作用,验证了DSS诱导的模型。
此外,据报道,前列腺素E2能够挽救由于DSS治疗而引起的粘液层损失和上皮屏障损伤,从而提供保护免受伤害,并且还显示了其他常用的IBD药物美沙拉敏和6-巯基嘌呤DSS模型中的保护作用。此外,DSS和TNBS诱导的幼虫小肠结肠炎模型已用于从大型临床化合物库中筛选小分子,使用肠道中的中性粒细胞积累作为读数。大多数命中是已知的抗生素或抗炎药,证实了筛选试验的有效性。使用该试验还可以鉴定出新型药物命中物,例如胆囊收缩素(CCK)和多巴胺受体激动剂,并通过使用CCK和多巴胺受体拮抗剂来证实这些受体的参与,这些拮抗剂在这些模型中被证明会加剧炎症。
七、结束语
动物模型的使用是生物医学研究的关键部分,对于新药的开发也至关重要。在诸如大鼠和小鼠的哺乳动物模型中已经建立了广泛的人类疾病模型,这在很大程度上促进了我们对这些疾病的潜在机理和新疗法的发展的理解。
然而,啮齿动物系统具有局限性,例如高昂的饲养和繁殖成本,并且它们不适用于大规模的自动筛选。过去几十年来,斑马鱼动物模型的发展增加了一个补充系统,该系统可以在体内进行自动高通量筛选,主要是由于斑马鱼幼虫的大小和透明度。斑马鱼和哺乳动物之间的免疫系统和炎症反应的相似性保证了良好的翻译价值。
为了模拟炎症疾病,斑马鱼已开发出三种类型的炎症模型:伤口,化学和突变诱导的炎症。这些模型使我们能够深入研究炎症反应背后的细胞和分子机制,从而增加了我们对白细胞行为机制和潜在药物靶标识别的认识。例如,使用斑马鱼模型,首次观察到在炎症反应开始时会产生组织规模的H2O2梯度,该信号会向组织中的白细胞发出信号,并且Lyn充当氧化还原传感器来介导白细胞的迁移。另外,所描述的模型已经用于筛选化合物文库。这导致发现了抗炎药物如ErbBs的重要新型靶标。
此外,测试或鉴定了各种候选药物,例如天然提取物[例如岩藻依聚糖,tashinone IIA和cymopol,沙利度胺类似物和PI3K抑制剂LY294002。
总而言之,这些斑马鱼的炎症模型已被证明对于阐明炎症反应的分子和细胞方面以及发现新的药物靶点非常有用。此外,这些模型已被证明是候选药物的有效筛选工具,为体外测定和啮齿类动物实验之间提供了一种中间产物,具有极大的潜力来加速抗炎药物开发的临床前阶段。
参考资料:
[1] Akira, S., and Takeda, K. (2004). Toll-like receptor signalling. Nat. Rev. Immunol.4, 499–511. doi: 10.1038/nri1391
[2] Alsop, D., and Vijayan, M. M. (2008). Development of the corticosteroid stressaxis and receptor expression in zebrafifish. Am. J. Physiol. Regul. Integr. Comp.Physiol. 294, R711–R719. doi: 10.1152/ajpregu.00671.2007
[3] Amatruda, J. F., Shepard, J. L., Stern, H. M., and Zon, L. I. (2002).Zebrafifish as a cancer model system. Cancer Cell 1, 229–231.doi: 10.1016/S1535-6108(02)00052-1