
NEWS
新闻中心
SERVERS
服务项目
NEWS
最新资讯
发布时间:2021-03-18
文丨Nilambari V. Pawar,* Pritee D. Singh, Padmaja S. Prabhu, and Jigarkumar R. RanaSection of Ecotoxicology, Department of Chemistry, Jai Research Foundation, Valvada, Gujarat, India
翻译丨杨小乐
发表于《Environmental Toxicology and Chemistry》Volume 40, Number 2—pp. 447–453, 2021

核心摘要
肿瘤血管生成是癌症药物开发的主要目标,发现靶向不同作用机制的抗血管生成剂是控制肿瘤生长和转移的主要研究领域。斑马鱼幼鱼是抗血管生成药物研发的重要临床前功效-毒性模型。
我们旨在使用致癌物林丹和苯并[a]芘来建立斑马鱼幼鱼中致癌物促血管生成的模型。斑马鱼被随机选择进行交配,产卵后,将健康的胚胎分批,分散在12孔板的反渗透水中,并在28.5°C下孵育,在受精后24小时内将其暴露于致死浓度以下的致癌物。暴露三天后,将胚胎用碱性磷酸酶染色,并使用明场显微镜对血管生成成像,测量并分析肠下血管的数量,从体节到肠下血管的长度以及其他促血管生成参数,引起肠下血管增长30%的苯并[a]芘和林丹的有效浓度为2.69和2.24 μm。
因此,证明了它们的促血管生成能力。斑马鱼幼鱼中由致癌物引起的促血管生成模型可以用作有效的高通量筛选工具,以评估致癌化合物的促血管生成潜力,并筛选抗血管生成药物以进行更好的治疗干预。
一、综述
血管生成在肿瘤的生成、转移扩散和脉管系统中起关键作用,它不断地向远处的肿瘤部位供应氧气、营养和生长因子。据报道,癌症是依赖新生血管的疾病。尽管血管生成会导致多种医学状况,例如牛皮癣,子宫内膜异位和动脉粥样硬化,但是癌症仍然是研究血管新生依赖性疾病。
由血管生成引发的疾病,需要对整个血管生成进行详细的了解。血管生成受与内皮发芽和非发芽的微血管发育相关的分子途径调控。为了开发抗癌疗法,使用药物和抑制剂的治疗方法对这些途径的靶向性至关重要。因此,对血管生成的深入了解对于药物发现和治疗进展是必不可少的。
为了追求癌症研究中的分子-药物学里程碑,优选动物模型以获得对肿瘤血管生成机制和抗血管生成疗法测试的深入了解,已经开发了使用啮齿动物和鸡胚的血管生成模型来筛选促血管生成和抗血管生成化合物。然而,使用高等动物进行高通量筛选通常是不可行的,并且耗资昂贵。
热带斑马鱼(Danio rerio)是探索基因功能、器官形成、药物发现和毒理学研究的有效研究模型。斑马鱼幼鱼比其他高等脊椎动物模型更受青睐,因为它们的维护成本低、透明度高、繁殖力强、适应性强、易于给药、胚胎发育迅速,且具有特征性的血管图案,发育期短。
斑马鱼的血管生成早在12 hpf即开始,到24 hpf时,随着躯干节间血管的发展,建立了一个由主要血管组成的简单循环回路;到24至48 hpf时,肠内血管(SIV)样的血管成芽在发育中的肠道中形成,以建立血管生成,从而可以评估抗血管生成剂。因此,斑马鱼有助于有效地了解肿瘤血管生成和转移,可以给斑马鱼胚胎施用血管生成化学物质和药物,以了解化学物质对恶性细胞存活和迁移的影响。
使用斑马鱼的正常脉管系统,发现抗血管生成药物的斑马鱼功效-毒性模型已被实施,以筛选具有不同作用机制的多种抗血管生成化合物,这些化合物针对斑马鱼胚胎幼鱼中的SIV并评估该模型的效力。这突出了斑马鱼功效-毒性模型在抗血管生成药物发现和血管生成高通量筛选方面的潜在能力。
生理性血管生成是一个紧密协调的过程,通过促血管生成和抗血管生成因子的平衡来调节,而肿瘤血管生成是不规则的,血管的形成不平衡。与正常脉管系统相比,肿瘤诱导的脉管系统表现出更深刻的形态功能修饰。因此,优选使用具有肿瘤诱导的血管生成的动物模型来有效筛选抗血管生成化合物并估计正常血管系统再次发生的药物有效浓度。通过将癌细胞移植到48hpf胚胎幼鱼中,已经在斑马鱼中建立了作为异种移植物的肿瘤血管生成模型。
尽管它是好技术,但在大规模筛选新化学实体方面,仍具有一定的局限性。该模型需要荧光标记的人类癌细胞、熟练的技术人员以及大量的肿瘤异种移植物。诱导血管生成的一种简便快捷的替代方法是使用致癌化学物质。
斑马鱼使用化学物质通过向水中添加致癌物建立了白血病、黑素瘤和睾丸癌等癌症类型,包括二苯并芘,7,2-二甲基苯并蒽, N-二甲基亚硝胺和N-亚硝基二乙胺、N-乙基‐N亚硝基脲。
苯并[a]芘作为存在于烟草烟雾的主要致癌物质,该化合物具有遗传毒性和致癌作用。根据国际癌症研究机构的说法,苯并[a]芘诱导凋亡,是一种人类易致癌物,在肿瘤的诱发率上至关重要。
林丹,一种有机氯杀虫剂和熏蒸剂,被用于农业中的种子处理和对付以土壤为食的植物性昆虫。林丹位列ToxCast I期化学品名单中,并在斑马鱼胚胎筛查中表现出发育毒性,其半数活性浓度为33.7175 µM。它是一种神经毒素,会增加肿瘤发展的风险。
暴露于苯并[a]芘和林丹,通常会增加肿瘤细胞的转移潜力和侵袭性。林丹激活雌激素受体α和扰乱内分泌系统,雌激素受体α在乳腺癌中发生中是关键的转录因子和关键的诊断预后因子。据报道,林丹已被用于通过离体和体外血管生成模型研究肿瘤血管生成。林丹的促血管生成能力已通过绒毛膜尿囊膜测定中新血管形成的发展得到了证明。因此,我们的目的是通过使用林丹和苯并[a]芘致癌物,开发一种由致癌物引起的斑马鱼胚胎幼鱼促血管生成的模型。
二、材料和方法
1、材料
本研究的测试化学品为林丹(Dr. Ehrenstorfer),苯并[a]芘 (Sigma-Aldrich),索拉非尼(Clearsynth Labs)和去铁胺甲磺酸盐(Clearsynth Labs)。硝化蓝四氮唑(NBT)–5–溴–4–氯–3'–二磷酸二甲苯酯(BCIP)盐底物储备溶液购自赛默飞科技(Thermo Fisher Scientific)。
2、斑马鱼血管生成测定
收集健康的胚胎,将同阶段的胚胎保存在12孔板的反渗透水中,每个孔包含12个胚胎,胚胎在28.5°C下孵育24小时。
在24 hpf下,将胚胎暴露于测试化学物质,每种浓度的测试化学物质均包含12个胚胎。抗血管生成化合物索拉非尼和促血管生成化合物去铁胺甲磺酸盐用作阳性对照,已知甲磺酸去铁胺通过血管内皮细胞功能触发血管生成。
索拉非尼是一种用于治疗肿瘤的靶向药物,是一种具有有效抗血管生成活性的多激酶抑制剂。为索拉非尼选择的测试浓度为0.1、0.25、0.5和1.0 µM。甲磺酸去铁胺的浓度为25、50、100和200 µM。
苯并[a]芘的测试浓度芘的浓度为0.0(对照),2.5、5.0、10.0和20.0 µM;根据先前进行的范围调查(数据不包括在内),林丹的浓度分别为0.0(对照),1.56、3.125、6.25和12.5 µM。所有测试化学品的储备溶液均在二甲亚砜(DMSO)中作为增溶剂制备,因此,包括了终浓度为0.1%DMSO的溶剂对照。
所有测试浓度均在含有0.003%(w / v)苯硫脲的反渗透水中进行脱色处理,并浸入斑马鱼胚胎中。处理后,将幼鱼幼鱼在28.5°C下孵育96 hpf(4 d)。在第4天,按照固定程序进行碱性磷酸酶染色。
在室温下,将实验幼鱼用低聚甲醛固定30分钟,然后使用冷却的丙酮脱水(在-20°C下30分钟)。幼鱼先用洗涤缓冲液(10×磷酸盐缓冲液+ 10%Tween 20)洗涤三次,然后用染色缓冲液(NTMT:5 M NaCl + 1 M Tris [pH 9.0–9.5] + 1 M氯化镁+ 10%Tween)洗涤20)。
加入染色溶液(NTMT缓冲液+ NBT-BCIP底物以1:1的比例),将幼鱼在室温下于黑暗中孵育30分钟或直到对血管进行染色。一旦染色,将幼鱼用洗涤缓冲液洗涤两次,然后用50%甘油和87%甘油平衡。然后将幼鱼储存在4°C的甘油中,直至下次使用。
3、参数成像和评分
使用明场显微镜对染色的幼鱼进行成像,重点放在血管网格生成上。使用巴斯德移液器将单个幼鱼小心地安装在腔载玻片上的固定介质(87%甘油)中,并放置在其侧面,以观察血管生成。捕获所有染色幼鱼的图像。
如图1所示, 使用ImageJ软件评估了每个幼鱼的血管生成参数(SIV的数量及其从体节到肠下血管底端生成的长度),并计算了血管生成参数,例如分支,内部分叉和篮变形。得分。利用这些信息,可以计算出甲磺酸去铁胺,苯并[a]芘的血管生成和促血管生成参数的百分比增加。control和林丹与对照相比(图 2和 3)。计算索拉非尼对血管生成参数的抑制百分比(图 2)。
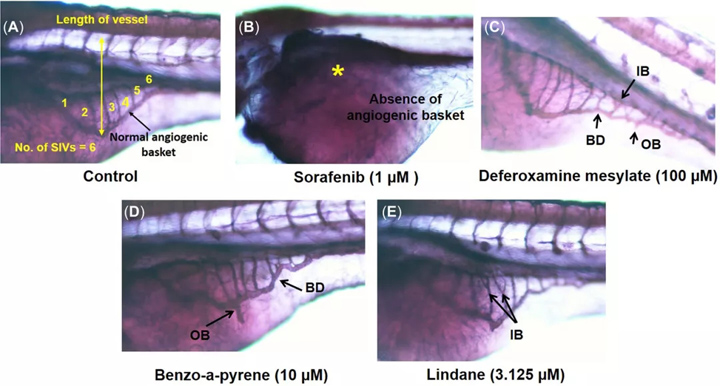
图1:碱性磷酸酶染色。对照中显示正常血管网格生成,显示血管生成参数(A);索拉非尼,抗血管生成阳性对照(B);去铁胺甲磺酸盐的促血管生成参数分支,内部分叉和篮变形(促血管生成阳性对照)(C);苯并[a]芘(D);和林丹(E)。BD =血管网格变形;IB =内部分叉;OB =分支;SIV =肠下血管。
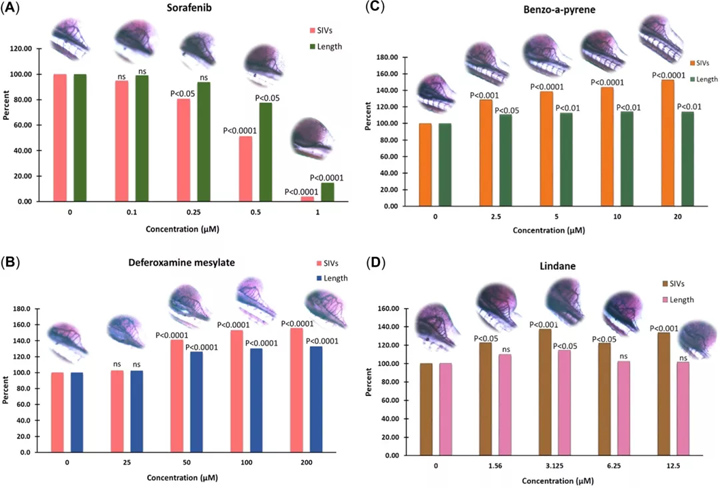
图2:暴露于索拉非尼(A),甲磺酸去铁胺(B),苯并[a]芘(C)和林丹(D)时,肠下血管的百分比和血管生成网格的长度。ns =无显著性;SIV =肠下血管。
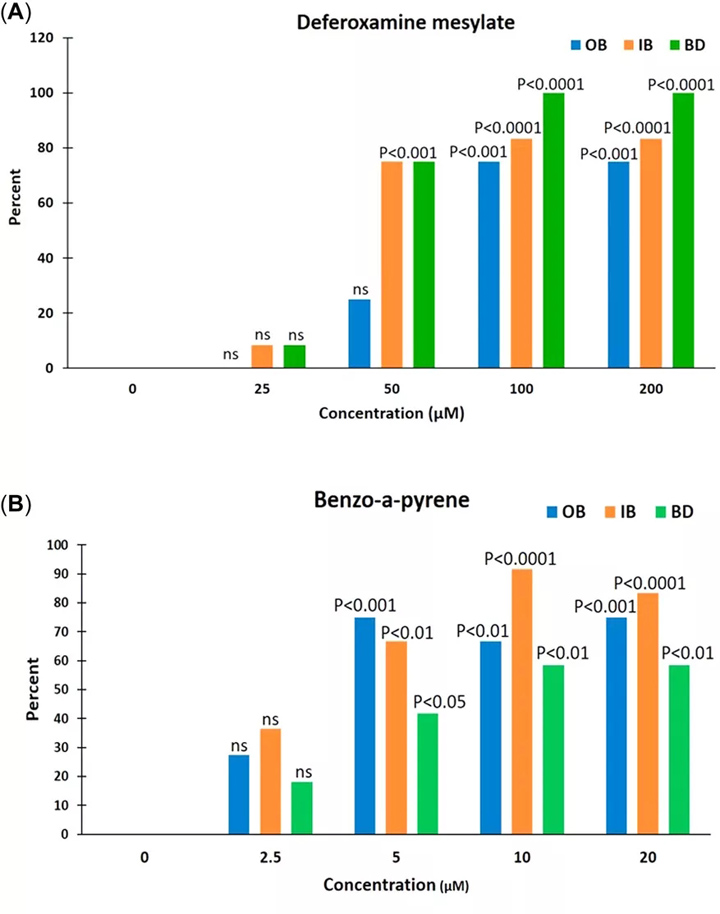
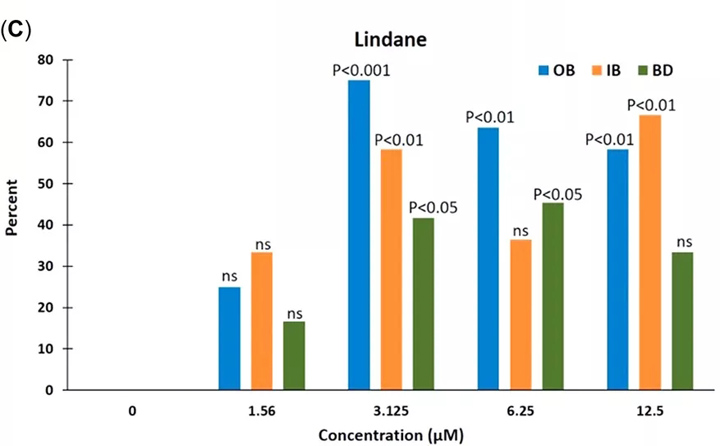
图3:对于去铁胺甲磺酸酯(促血管生成参数的百分比A),苯并[a]芘(B),和林丹(Ç)。BD =血管网格变形;IB =内部分叉;OB =分支。
三、结果与讨论
由于使用了4种测试化学品的亚致死浓度进行处理,所以,所有处理过的幼鱼在处理终止时(96 hpf)和碱性磷酸酶染色之前都还活着。本研究中使用的DMSO(0.1%)和苯硫脲(0.003%)的浓度是安全的,对斑马鱼胚胎的形态没有影响。将治疗与溶剂对照组(以下称为“对照组”)进行比较,进行所有计算。
苯并[a]芘中的幼鱼在任何测试浓度下,和甲磺酸去铁胺均未表现出任何畸形或明显的毒性。在1 µM索拉非尼暴露的幼鱼中观察到心包水肿,这与(Chimote et al. 2014)观察到的脱靶效应相当。用林丹处理的幼鱼在6.25和12.5 µM浓度下显示脊柱侧弯。对于所有的测试化学品的百分比增加或减少的SIV和血管长度相比归一化至100%的控制的数目(图血管生成参数进行了评价 2)。
染色后,对对照组中的所有12个幼鱼以及索拉非尼和甲磺酸去铁胺的所有治疗组进行成像,并对血管生成参数进行评分。一只幼鱼,浓度为2.5 µM苯并[a]芘和6.25 µM的林丹中的另一种在处理过程中被破坏;因此,对这些浓度的11个幼鱼进行了成像和评分,对于其余浓度,所有浓度均由12个幼鱼组成。
在所有浓度下,除了林丹的2种较高浓度外,所有测试化学品的血管生成参数均呈现浓度依赖性趋势(图 2)。将去铁胺甲磺酸盐,苯并[a]芘和林丹的促血管生成参数记为计数数据(即,显示出所成像幼鱼总数的幼鱼数量),表示为分支,内部分叉和网格增加的百分比与对照相比的失真归一化为0%(图 3)。
促血管生成参数显示在所有浓度下甲磺酸去铁胺,苯并[a]芘和林丹的浓度依赖性增加,但林丹的浓度较高时除外(图 3)。在林丹的2种较高浓度(6.25和12.5 µM)下,在处理过的幼鱼中观察到的全身毒性可能已经影响了这2种浓度下的血管生成和促血管生成参数。
通过计算有效浓度,从其浓度-反应模型中确定每种SIV数量的变化,可以确定每种测试化学品的抗血管生成或促血管生成功效。有效浓度(EC30)定义为与对照组的平均SIV相比,SIV数量变化30%的测试浓度。
SIV的数量是一个参数,考虑了EC30的测定,因为可以为所有测试化学品计算得出EC30。索拉非尼,甲磺酸去铁胺和苯并[a]芘的所有浓度进行有效浓度计算。对于林丹,仅使用显示浓度-反应模型的两个较低浓度组。索拉非尼的EC30为0.30 µM,导致SIV抑制30%。甲磺酸去铁胺,苯并[a]芘和林丹的EC30分别为55.8、2.69和2.24 µM,导致SIV增加30%(表 1)。
表1. 观察到的影响浓度,中值致死浓度和引起受试化学物质肠下血管变化30%的有效浓度的比较
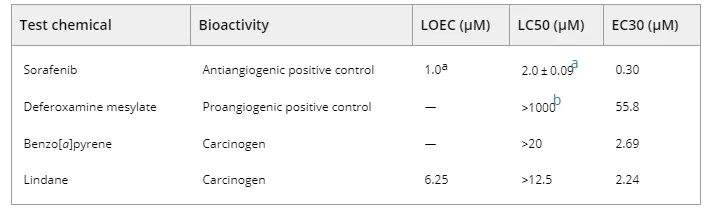
a Chimote et al. (2014).
b Hamilton et al. (2014).
— =无;EC30 =引起肠下血管变化30%的有效浓度;LC50 =致死浓度中位数;LOEC =观察到的浓度。
根据之前进行的范围研究(不包括数据),苯并[a]芘和林丹的致死浓度中位数(LC50)分别为> 20和> 12.5 µM。没有测试更高的浓度,因为它们沉淀在反渗透水中。表 1比较了观察到的浓度,测试化学品的LC50和EC30。计算出的EC30小于测试致癌物以及两种阳性化学品的LC50。
相比绒毛膜尿囊膜测定中刺激血管生成所需的20 mg / L(〜69 µM)林丹浓度水平(Bharathi et al. 2013年)和约4 µM苯并[a]芘需要增加MDA-MB-231细胞的转移潜能和侵袭力(Milleret al. 2005年),我们的斑马鱼模型在林丹中的有效浓度为2.24 µM,对苯并[a]芘的有效浓度为2.69 µM,表现出血管生成刺激作用, SIV增加30%。这证明了在安全浓度下,两种受试致癌物在斑马鱼胚胎-幼鱼模型中诱导血管生成的效力更高,而不会干扰任何其他系统毒性或畸形。
致癌物诱导的肿瘤模型是发展血管生成的一种简便快捷的替代方法,因此,本研究使用了这种方法。尽管已知化学致癌作用显示出较晚发病且肿瘤形成的发生率较低(Stoletov and Klemke 2008),但我们在林丹和苯并[a]芘暴露后仅3 d内观察到对斑马鱼血管网格的影响,且2阳性化合物。这可能是由于斑马鱼发育阶段的选择。胚胎中的肿瘤发展比成年个体更快。此外,胚胎具有透明体的优势,可以轻松进行显微镜观察(Letrado et al. 2018)。我们使用2种阳性测试化学品甲磺酸去铁胺和索拉非尼评估了我们的测试生物斑马鱼胚胎幼鱼对血管生成测定的敏感性。
本研究表明,斑马鱼是更好地了解体内肿瘤血管生成的有效手段。这可以为治疗方法的发展,肿瘤进展和患者预后提供新的见解。此外,本研究建议斑马鱼的促血管生成筛选模型可以潜在地补充高级动物模型,提供有关肿瘤血管生成的分子机制的详细信息,并提供高通量筛选平台。
本研究的发现表明,苯并[a]芘和林丹具有促血管生成作用,这很明显,因为它们具有破坏血管网格生成的潜力,如由注射肿瘤细胞观察到的那样,可引起血管的内部和外部分支。因此,有效浓度可用于建立促血管生成模型。使用斑马鱼对血管生成进行高通量筛选,可以根据致癌物对正在发展的SIV的新生血管反应,评估和比较肿瘤细胞的抗血管生成和促血管生成活性。
可以移植大量的斑马鱼胚胎,并且它们对小分子具有渗透性,因此使用斑马鱼筛选血管生成受到关注。针对多种抗血管生成分子进行测试和验证正在进行中(Moshal等, 2011)。然而,仍然需要建立大规模的体内定量检测方法来测量肿瘤诱导的血管生成(Moshalet al., 2011年)。对此,本研究建议考虑将血管的数量和长度以及血管网格生成的形成作为可靠,一致的参数,以量化斑马鱼胚胎幼鱼中的肿瘤血管生成。
这种斑马鱼促血管生成模型可以用作双重目的的高通量筛选工具:1)筛选化合物的促血管生成/致癌潜力,从而选择进入农业市场的更安全的化合物,并对有害污染物进行癌症风险评估和2)筛选癌症药物发现中潜在的抗血管生成化合物。
四、结论
本研究的结果成功地证明了使用林丹和苯并[a]芘的斑马鱼促血管生成模型的发现。斑马鱼的促血管生成模型可用于筛选一系列具有促血管生成/致癌潜力的化合物,致癌物诱导的促血管生成模型也可以用于筛选癌症药物发现中潜在的抗血管生成化合物,可以进一步探索该模型以鉴定由致癌物发展的特定癌症类型,从而用作筛选针对特定癌症类型的新化学实体的功效模型。
通过减少使用高级动物,减少时间和降低成本,这将有助于加快早期的临床前体药物的发现过程。
参考资料:
[1] Bharathi SP, Raj HM, Jain S, Banerjee BD, Ahmed T, Arora VK. 2013. Role of pesticides in the induction of tumor angiogenesis. Anticancer Res 33:231–240.
[2] Carmeliet P, Jain RK. 2000. Angiogenesis in cancer and other diseases.Nature 407:249–257.
[3] Chimote G, Sreenivasan J, Pawar N, Subramanian J, Sivaramakrishnan H, Sharma S. 2014. Comparison of effects of anti‐angiogenic agents in the zebrafish efficacy–toxicity model for translational anti‐angiogenic drug discovery. Drug Des Devel Ther 8:1107–1123.