
NEWS
新闻中心
SERVERS
服务项目
NEWS
最新资讯
发布时间:2021-04-09
文丨Hanliang He, Chunqing Wang, Qifeng Tang, Fan Yang, Youjia Xu
翻译丨周佳丽
发表于《Biomedicine & Pharmacotherapy》, February 2018, No. 101
核心摘要
糖皮质激素诱发的骨质疏松症(GIOP)是一种严重的临床骨病,其原因是长期服用糖皮质激素或类糖皮质激素类药物。尽管许多研究试图确定GIOP的机制,但仍不清楚。
在这项研究中,我们通过用泼尼松龙治疗幼鱼,建立了糖皮质激素样药物诱发的骨质疏松症的斑马鱼模型。然后,我们量化了选择的细胞外基质的表达(ECM),成骨细胞和破骨细胞相关基因。我们的结果表明,受精后15天,用25μM泼尼松龙处理的斑马鱼幼鱼是GIOP的合适模型,这不仅是由于健壮骨量的减少,而且还因为基因表达的显著改变。对ECM ,成骨细胞和破骨细胞相关基因表达的定量分析表明, mmp9和mmp13显著上调,而entpd5a, acp5a和sost显著下调。这些基因可能成为未来GIOP研究的目标。因此,我们的研究为GIOP提供了新的见解。

一、综述
皮质类固醇具有抗炎和免疫抑制功能,因此在临床上用于治疗各种疾病。然而,长期使用的糖皮质激素(GCS)或GCS样药物可降低骨矿物质密度,并增加骨折的风险,这被称为GCS诱导的骨质疏松症(GIOP)。GIOP的主要原因是用GCS进行外源性治疗,但是内源性皮质醇过高(例如在库欣综合征的情况下)也可能引起GIOP。GIOP是继发性骨质疏松症常见的形式,主要见于老年人。临床资料显示的GCS降低骨质密度(BMD)和骨质量。因此,GIOP对生活质量产生了很大的负面影响。
成骨细胞和破骨细胞是GCS直接靶向的 。研究表明,GCS的治疗可导致凋亡增加,并损害成骨细胞的分化。GCS治疗可激活caspase-3和GSK-3β,从而诱导成骨细胞凋亡。GCS还通过引起抑制剂dickkopf-1(DKK-1)的增加来抑制Wnt信号通路。沉默DKK-1被证明可以消除GC诱导的成骨细胞分化。破骨细胞也是GCS的目标。贾等揭示GCS可延长破骨细胞的寿命。这些似乎与核因子-κB配体的受体激活剂的激活(RANKL)和骨保护素(OPG)的下调相关,后者属于肿瘤坏死因子(TNF)受体家族。
除了对成骨细胞和破骨细胞的直接作用外,GCS还可以通过对细胞外基质(ECM)的作用间接引起骨损伤。GCS通过抑制骨钙素和胶原蛋白I(这是ECM的两个重要蛋白)的转录来影响骨骼矿化。在临床上,钙和维生素D的补充已被证明对GIOP的治疗至关重要。基质金属蛋白酶(MMP)属于可以降解所有类型ECM蛋白的蛋白酶家族。Sun等揭示泼尼松龙诱导小鼠MMP2 ,MMP9和MMP13升高。
斑马鱼为基础的生物医学研究提供了一个出色的模型系统。GIOP的斑马鱼模型于2006年建立。但是,成年斑马鱼已被用于GIOP研究中,尤其是它们的鳞片。埃尔·德·弗里兹 用泼尼松龙对斑马鱼进行处理后发现,GCS可在再生规模内诱导GIOP表型,增加基质分解并破坏成骨细胞和破骨细胞的表达。已显示阿仑膦酸盐可以拯救成年斑马鱼的骨质疏松症表型。
为了探索GIOP的机制,我们采用了斑马鱼的幼鱼来鉴定涉及的基因。首先,我们在受精后(dpf)的第5天用0.5、5和25μM泼尼松龙处理斑马鱼的幼鱼,然后在8、10、12和15 dpf采样幼鱼,以进行整个骨架的染色并量化ECM-,成骨细胞和破骨细胞相关的基因表达。我们发现泼尼松龙导致了斑马鱼幼鱼的骨质疏松症表型,与DMSO治疗的对照组相比,尤其是在15 dpf浓度为25μM的情况下。实时定量PCR(qRT-PCR)分析显示ECM-(mmp2,mmp9,mmp13,col2a1a,sparc和timp2a),成骨细胞(runx2b,SP7,entpd5a,SPP1,ALP,和bglap2)和破骨细胞(C TSK,acp5a,RANKL,OPG,enppl和SOST)相关的基因表达。因此,我们的研究为GIOP提供了新的见解。
二、实验结果
2.1 泼尼松龙在斑马鱼幼鱼中引起骨质疏松症表型
为了探索斑马鱼幼鱼中的GIOP,对5 dpf斑马鱼幼鱼进行了不同浓度(0、0.5、5和25μM泼尼松龙的处理),并在8,10、12和15 dpf进行了整个骨骼的染色。结果表明,泼尼松龙治疗组的骨组织染色面积减少。骨含量的变化既显示出剂量依赖性,也显示了发育时间依赖性(图1和图2)。与DMSO治疗的对照组相比,高浓度的泼尼松龙可导致严重的骨骼减少(图1,图2)。在25μM泼尼松龙治疗后15 dpf处观察到严重的骨骼减少(图1 P和2C)。因此,数据表明泼尼松龙在斑马鱼幼鱼中引起骨质疏松症表型。
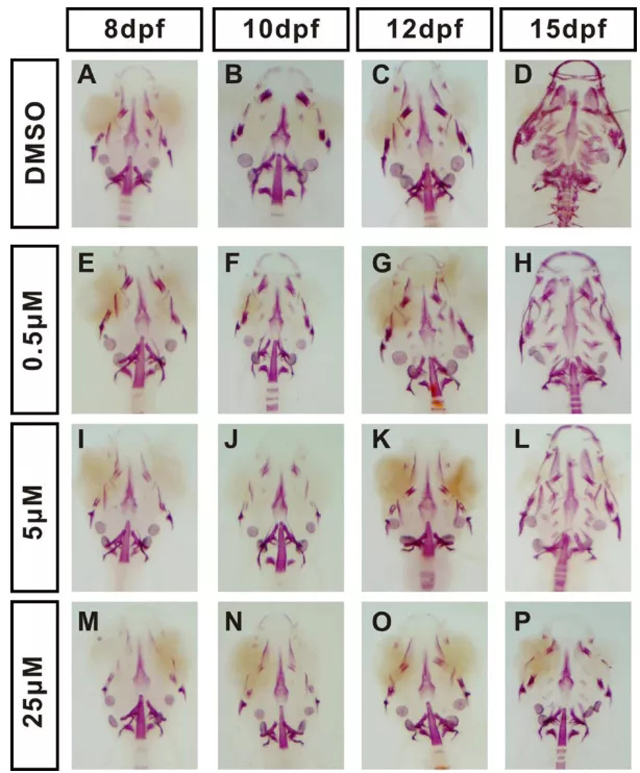
图1. 斑马鱼幼鱼在8、10、12和15 dpf时不同浓度的泼尼松龙治疗会引起骨质疏松症表型。幼鱼分别在8、10、12和15 dpf采样,并在固定的组织上进行骨骼染色。矿化组织呈红色染色。
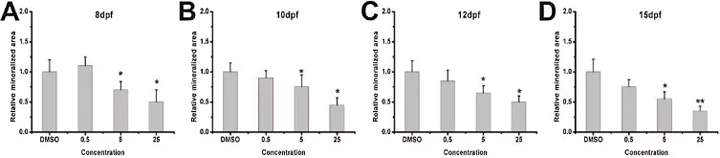
图2. 数字图像分析可量化染色区域和染色密度。(A)8 dpf的相对矿化面积的变化。(B)在10 dpf时相对矿化面积的变化。(C)在12 dpf时相对矿化面积的变化。(D)15 dpf的相对矿化面积的变化。
2.2 暴露于不同浓度的泼尼松龙可改变ECM相关基因的表达方式
为了探索泼尼松龙引起骨质疏松的机制,进行了基因表达分析。根据以往的研究,我们选择了几个ECM、成骨细胞,破骨细胞和相关基因。细胞分泌的ECM在骨骼发育和骨骼功能中起重要作用。
我们调查了不同浓度的泼尼松龙治疗后mmp2,mmp9,mmp13,col2a1a,sparc和timp2a的表达。结果表明,mmp2与DMSO处理的对照组相比,在5和25μM的处理组中,其在8 dpf时被上调。在10、12和15 dpf时,在0 . 5和5μM泼尼松龙治疗组中 ,mmp9和mmp13表达的变化相似 ,在10d pf时显著下降 ,但在12和15d pf时显著上调 ,特别是在25μM泼尼松龙治疗后(图3 B和C)。在5和25μM泼尼松龙治疗组中,col2ala的表达在8 dpf时增加,但在10、12和15 dpf时降低(图3 D)。表达在5和25μM泼尼松龙治疗组中,sparc在15 dpf时下降(图3 E)。在5和25μM处理组中,timp2a的表达在8 dpf时降低,但在8 dpf和15 dpf时表达增加(图3 F)。数据显示泼尼松龙破坏了ECM相关基因的表达。
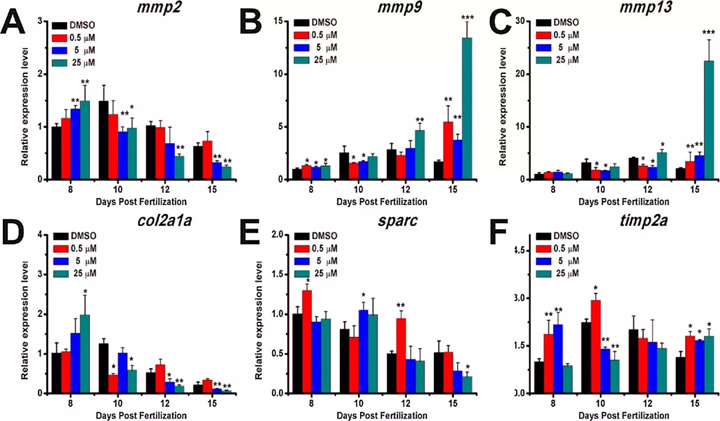
图3. 用不同浓度的泼尼松龙处理后,ECM相关基因在8、10、12和15 dpf处的表达模式。(A)mmp2 ; (B)mmp9;(C)mmp13;(D)col2a1a;(E)sparc ; (F)timp2a。进行了三个独立的实验。
2.3 暴露于不同浓度的泼尼松龙可改变成骨细胞相关基因的表达模式
以前有泼尼松龙抑制成骨细胞分化的报道[ 8 ]。我们选择runx2b,sp7,entpd5a,spp1,alp和bglap2作为六个合适的成骨细胞相关基因,以研究泼尼松龙对成骨细胞功能的影响。在成骨细胞分化过程中,重要的转录因子runx2在0.5和5μM处理组中均以8 dpf上调,而在所有处理组中均以10 dpf上调(图4 A)。
泼尼松龙治疗导致sp7上调在0.5和5μM处理组中,在8 dpf时浓度为10 dpf,在所有处理组中分别为10 dpf和15 dpf时下调(图4 B)。emdpd5a的表达随发育阶段增加而增加,但在泼尼松龙处理后的10、12和15 dpf处表达显著下调(图4 C)。SPP1的表达在8 DPF中被上调,但是在晚期发育期下调(图4 d)。泼尼松龙处理后,alp的表达在8和10 dpf时增加,但在12 dpf时下调。在15 dpf时,在0.5μM处理组中alp表达增加,而在5和25μM处理组中alp表达下降(图4)。E)。bglap2的表达在0.5和5μM的治疗组8dpf被上调,但是在10,12和15dpf下调,(图4 F)。我们的数据表明泼尼松龙破坏了斑马鱼幼鱼中成骨细胞相关基因的表达模式。
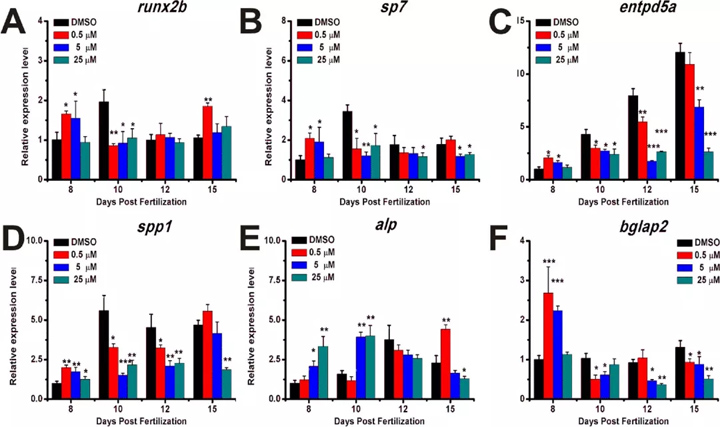
图4. 用不同浓度的泼尼松龙处理后,成骨细胞相关基因在8、10、12和15 dpf处的表达模式。(A)runx2b ; (B)sp7;(C)entpd5a;(D)spp1 ; (E)alp;(F)bglap2。进行了三个独立的实验。
2.4 暴露于不同浓度的泼尼松龙可改变破骨细胞相关基因的表达模式
破骨细胞也是泼尼松龙的靶细胞。为了检测强的松龙是否在不同发育阶段影响破骨细胞 ,泼尼松治疗后检查CTSK, acp5a, RANKL, OPG, enppl和SOST表达。结果表明,在5μM处理后ctsk在12 dpf下调,但在0.5μM处理后在15 dpf上调(图5 A)。
acp5a的表达随发育进程而增加,并在5和25μM泼尼松龙处理下显著降低(图5 B)。基因RANKL和OPG是在两个功能上相对的基因破骨细胞分化。用泼尼松龙治疗后,泼尼松龙经5μM处理后,rankl表达在8 dpf时增加,但在10 dpf和12 dpf时下调,在15 dpf时未发现差异(图5 C)。通过5和25μM泼尼松龙处理,opg的表达在8和15 dpf时增加,但在10和12 dpf时下调(图5 D)。泼尼松龙治疗后,enppl的表达在8和10 dpf时被上调,而在12和15 dpf时被下调(图5 E)。在几乎所有泼尼松龙治疗组中,sost作为骨形成的关键因素,其表达以发育时间依赖性 的方式增加,但在10 、 12和15dpf时显著降低(图5 F)。因此,数据显示泼尼松龙破坏了斑马鱼幼鱼中的破骨细胞相关基因表达模式。
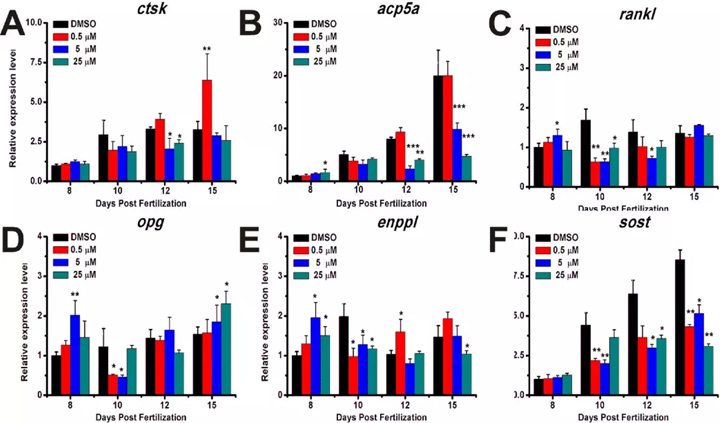
图5. 用不同浓度的泼尼松龙处理后,成骨细胞相关基因在8、10、12和15 dpf处的表达模式。(A)ctsk ; (B)acp5a;(C)rankl; (D)opg ; (E)enppl;(F)sost。进行了三个独立的实验。
三、讨论
GCS是用于治疗许多人类疾病(尤其是具有抗炎性质的疾病)的高效药物。但是,长期服用GCS会引起骨质疏松症的严重副作用。GIOP是继发性骨质疏松症的常见形式,已导致许多患者骨折的风险增加。尽管许多研究都集中在这一领域,但有关GIOP的详细致病机理和有效临床治疗方法尚不完全清楚。GIOP的斑马鱼幼鱼模型是由Barrett等人于2006年初建立的。在此模型中,用25μM泼尼松龙治疗斑马鱼幼鱼会导致10dpf时骨量显著减少 ,与我们的结果一致(图2 B和N)。但是,我们发现15 dpf斑马鱼由于健壮的骨量减少(图1 P和C)以及基因表达的显著改变(图3 B和C,4 C,5)而更适合GIOP研究。
为了探索ECM在GIOP中的功能,我们量化了泼尼松龙治疗后6个ECM相关基因的表达。mmp2,mmp9和mmp13是基质金属蛋白酶,主要降解ECM;col2a1a,一种调节骨形成的重要胶原蛋白;sparc,它编码骨胶原中钙化所需的富含半胱氨酸的酸性基质相关蛋白,还参与ECM合成和促进细胞形态的改变;timp2a ,它是MMP的抑制剂和组织的调节剂稳态。我们的结果表明,泼尼松龙治疗组在15 dpf时mmp9和mmp13显著上调,这与小鼠报道的结果一致。
但是,我们观察到泼尼松龙治疗组中mmp2在15 dpf下调,这可能归因于mmp2, mmp9和mmp13在斑马鱼途径调控方面的功能差异。此外,通过增加mmp9和mmp13可以确认col2a1a和sparc的表达降低; 此外,MMPs抑制剂timp2a的显著减少证实了这些结果。我们没有证明timp2a的下调是否直接导致mmp9和mmp13的上调,但是没有表明timp2a的上调导致胶原蛋白或其他ECM组分的降解,因此有助于GIOP。
许多研究人员已经报告了泼尼松龙对成骨细胞的作用。它显示出对成骨细胞和破骨细胞的数量,活性和分化的影响。因此,我们选择了六个成骨细胞相关基因来检查泼尼松龙如何影响破骨细胞。该基因runx2b和SP7起到分化和形成的成骨细胞的重要作用,但在某些发育阶段泼尼松治疗后仅表现显著差异; 因此,这些基因可能不是泼尼松龙的直接靶标。基因entpd5a编码一种胞外核苷三磷酸二磷酸水解酶,并且是参与ECM生产的成骨细胞的标记基因。entpd5a的表达是发育时间依赖性的,从8 dpf增加到15 dpf,这与伴随骨形成的成骨细胞数量增加是一致的。泼尼松龙治疗后,entpd5a表达显著降低,表明泼尼松龙减少了骨形成中成骨细胞的数量。spp1基因(分泌的磷蛋白1)和bglap2基因(骨γ-羧基谷氨酸蛋白2),与成骨细胞分化有关,被发现在8 dpf时被上调,但在后来的时间(10、12和15 dpf)时被下调。在早期观察到的表达增加可能是对泼尼松龙治疗的一种补偿作用。alp(碱性磷酸酶)基因是成骨细胞的标志物,在泼尼松龙处理后显示出与spp1类似的表达模式,这揭示了泼尼松龙对成骨细胞的作用。
破骨细胞对于骨稳态很重要,据报道它受到GCS的影响。基因rankl (核因子-κB配体的受体激活剂)和opg (骨保护素)是破骨细胞分化的重要因素,并通过关键的RANKL / RANK / OPG途径发挥作用。Rankl是一种破骨细胞激活因子,其表达仅在某些发育阶段发生改变,这表明泼尼松龙并没有通过这些基因直接影响斑马鱼幼鱼的破骨细胞。
此外,25 μM泼尼松治疗组在15 dpf时,opg是破骨细胞分化的阴性因子,这与小鼠和斑马鱼鱼鳞的结果不同。根据以前的结果,泼尼松龙的短期给药导致opg下调,破骨细胞分化的激活,然后导致骨质疏松。然而,长时间的泼尼松龙治疗严重损害破骨细胞功能。
因此,我们认为泼尼松龙可能对opg表达具有双重影响。短期泼尼松龙治疗导致opg表达下调和破骨细胞分化激活; 长期泼尼松治疗opg表达上调和破骨细胞受损。在哺乳动物破骨细胞,糖皮质激素治疗可影响细胞凋亡。斑马鱼的实验表明泼尼松龙的治疗方法可以大大减少斑马鱼幼鱼和鳞屑中的破骨细胞数量,这证实了上述假设。在先前的研究中,有报道称破骨细胞在15 dpf时不存在。然而,研究表明,11 dpf斑马鱼幼鱼被抗酒石酸酸性磷酸酶(TRAP)染色,这表明斑马鱼幼鱼中存在破骨细胞。TRAP编码为酸性磷酸酶5,抗酒石酸盐(acp5)。acp5a的定量显示了8 dpf和15 dpf之间的时间依赖性增长,这意味着随着斑马鱼的发展,破骨细胞的产生越来越多。泼尼松龙治疗后,acp5a的减少可能解释了破骨细胞数量的减少,这与在斑马鱼幼鱼和鳞片中获得的结果一致。SOST的表达模式与acp5a相似,并且显示从8〜15dpf发育时间依赖性增加。泼尼松龙治疗后,SOST表达减少。该基因sost编码了硬化蛋白,该蛋白先前已被证明是骨形成的抑制剂,而一项研究报道,针对硬化蛋白的抗体可以预防小鼠的GIOP。但是,硬化素参与GIOP尚需进一步研究。
四、结论
斑马鱼幼鱼是GIOP体内分析的理想模型。我们的研究表明,用25μM泼尼松龙处理的15 dpf斑马鱼适合进行GIOP研究,这不仅是因为坚固的骨量减少了,而且还因为基因表达发生显著改变。
我们对ECM,成骨细胞和破骨细胞相关基因表达的定量揭示了泼尼松龙引起GIOP的机制,可能是通过ECM,成骨细胞和破骨细胞引起的。上调的基因mmp9和mmp13以及下调的基因entpd5a,acp5a和sost,可能会成为GIOP未来研究的目标。我们的研究为GIOP提供了宝贵的见解。
参考资料:
[1] R.H. Straub, M. Cutolo, Glucocorticoids and chronic inflammation, Rheumatology (Oxf.) 55 (2016) ii6–ii14.
[2] I.R. Reid, Glucocorticoid osteoporosis–mechanisms and management, Eur. J.Endocrinol. 137 (1997) 209–217.
[3] D. Jia, C.A. O’Brien, S.A. Stewart, S.C. Manolagas, R.S. Weinstein, Glucocorticoidsact directly on osteoclasts to increase their life span and reduce bone density,Endocrinology 147 (2006) 5592–5599.