
NEWS
新闻中心
SERVERS
服务项目
NEWS
最新资讯
发布时间:2021-04-01
文丨Vincenzo Torraca and Serge Mostowy
翻译丨陆夏逸
发表于《Trends in Cell Biology》, February 2018, Vol. 28, No. 2
核心摘要
宿主与病原体相互作用的研究阐明了感染和细胞生物学的基础研究途径。斑马鱼幼鱼在遗传上易于处理,光学上透明,具有功能齐全的先天免疫系统,且巨噬细胞和中性粒细胞与哺乳动物类似。
使用斑马鱼模型研究各种各样的致病菌,为细胞对体内感染的反应提供了全新的解决方案。在这篇综述中,我们说明了通过斑马鱼模型体内平台来研究从单细胞到整个动物水平的宿主-病原体的相互作用,促进我们理解细胞微生物学的相互作用。 我们还强调了从斑马鱼感染中获得的发现,这些发现为将其转化为人类的新疗法带来了希望。

一、细胞生物学:斑马鱼平台
斑马鱼胚胎的透明度在大约一个世纪前首次引起了发育生物学家的注意。斑马鱼胚胎发生快速,在子宫外发生,易于在体内进行无创性膀胱内成像和纵向分析。20世纪80年代,利用斑马鱼的遗传和化学可处理性的研究爆发(图1),这是当时脊椎动物模型前所未有的特征。
光学可达性和遗传可处理性的结合使研究人员能够为高分辨率荧光显微镜标记蛋白质和细胞类型。斑马鱼还能够通过过表达、短暂的消耗或基因组编辑来表征基因功能。获得数百个胚胎的容易性,结合通过浴水暴露进行药理治疗的可能性,允许高通量分析,这一特征以前只适用于组织培养细胞或无脊椎动物物种。斑马鱼的基因组已经被完全测序,突出了与人类的显著相似性。至少70%的人类编码基因组,包括与疾病相关的基因,在斑马鱼中具有直接的同源基因。总的来说,斑马鱼胚胎和幼鱼在21世纪被广泛接受为各种人类疾病的体内模型,包括癌症、炎症性疾病和感染。
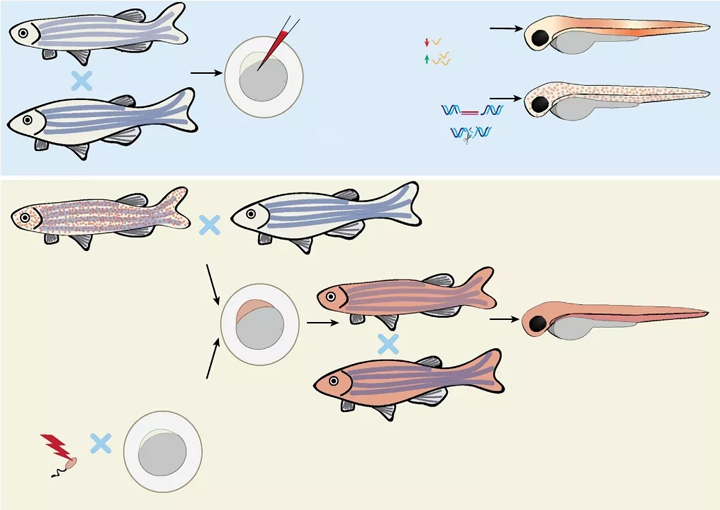
图1所示,斑马鱼基因控制方法。(A)在斑马鱼卵中注入结构体和化学物质。瞬时消耗可以通过注射吗啡啉寡核苷酸来实现,这是一种rna结合寡聚物,可以阻止特定(pre)-mRNA的翻译/成熟。Morpholinos有时会引起脱靶效应,因此,在完全得出结论之前,使用替代策略和/或挽救实验验证表型是很重要的。将合成的携带表达载体的mRNA或质粒DNA注入体内,即可获得基因的瞬时表达。注射的mrna会广泛表达,而注射质粒可以实现细胞或组织特异性表达。斑马鱼卵可以稳定地整合DNA,可用于获得稳定的转基因株系或插入突变体。当单独注射DNA时,转基因的频率较低,但可以通过转座酶(如:Tol2)或大核酶(即, I-SceI meganuclease)。ZFNs、TALENs或CRISPR/Cas9可以有效地产生斑马鱼稳定突变体。这些系统是基于诱导位点特异性双股断裂,这是通过一个容易出错的非同源端连接机制修复。CRISPR/Cas9系统已成为产生斑马鱼突变体的常用方法。此外,CRISPR/Cas9系统还被用于产生条件/组织特异性敲除。突变体是通过在斑马鱼卵中注入用于核酸酶的mRNA或蛋白(在CRISPR/Cas9中与引导RNA一起)获得的。条件/组织特异性突变体是通过整合一个由可诱导的或组织特异性启动子控制的Cas9表达的构造而获得的。为稳定整合而设计的DNA结构可以与侧翼同源重组臂相结合,驱动整合到一个精确的位点,并允许生成敲入序列。精确敲入斑马鱼仍然具有挑战性,但可以通过在感兴趣的位点引入双链断裂(即:使用TALENs或CRISPR/Cas9)。使用这些技术操作的胚胎可以用于下游功能研究,或者,在稳定修改的情况下,被培养到成年建立一个新的细胞系。(B)选择稳定的转基因或突变株系。来自(A)的携带者可以异交获得杂合子携带者。这些后代可以用来做实验,也可以养大到成年并进行近亲繁殖,以获得纯合子。(C)系统的突变。通过将精子暴露于化学或物理诱变剂(即:ENU或g-辐射)。
斑马鱼模型于1999年进入宿主-病原体相互作用领域,PhilippeHerbomel和他的同事描述了受精后22小时(HP F)在发育中胚胎中出现的原始巨噬细胞,这些细胞模仿保护哺乳动物胚胎的原始巨噬细胞,并观察到清除静脉注射革兰氏阴性(大肠杆菌)和革兰氏阳性(枯草芽孢杆菌)细菌。从大约36hpf,原始中性粒细胞出现,并与巨噬细胞协同宿主防御。由于先天免疫细胞的早期出现以及通过显微注射进行局部和全身感染的能力(图2),斑马鱼已经建立了多种细菌、病毒和真菌病原体的感染模型。
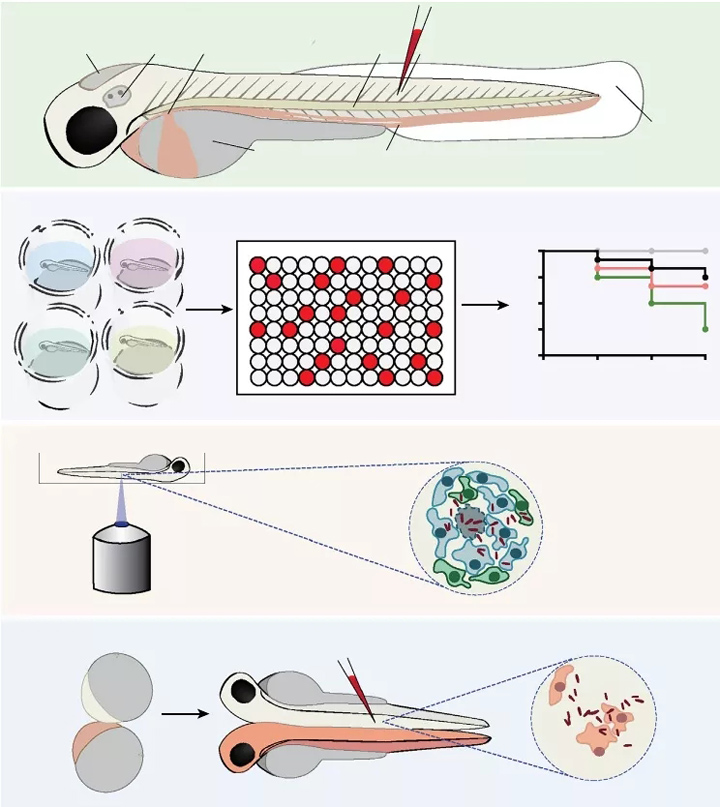
图2 用斑马鱼研究宿主-病原体相互作用的方法。(A)斑马鱼注射途径。幼鱼可局部注射入YS或体腔,如HV和OV。其他注射室包括SC、IM或NC。HV, OV, IM和TF感染都允许研究免疫细胞招募。免疫细胞无法接触到NC,但对骨和软骨炎症模型很有价值。可通过静脉注射进入循环,例如通过CV/BI或DC。这导致微生物在全身迅速的系统传播。(B)化学治疗。斑马鱼适合于毒理学研究和生物活性化合物库的筛选,包括抗菌剂,因为洗澡水中的分子可以通过斑马鱼的皮肤吸收。生存和细菌负担可以被量化,以比较不同遗传条件的易感性或评估化学品/治疗方法在疾病预防中的效果。(C)活体的成像。通过结合荧光标记的细菌和报告特定基因表达模式或标记特定细胞类型的斑马鱼转基因株系,可以在体内跟踪宿主-病原体相互作用。各种蛋白质和亚细胞室也可以通过融合特定标记与荧光标记来标记。(D)异种共生。通过外科手术使两个斑马鱼胚胎的囊胚直接接触,就可以实现融合。这将导致共享血液循环和身体部位的联合胚胎的发育,使分泌因子和循环细胞在两个人的身体中分布。当应用于具有不同基因/转基因组成的胚胎时,这项技术有助于区分细胞自主功能和非细胞自主功能。
本文涵盖斑马鱼-微生物相互作用的整个领域,在这里,我们集中在研究中,斑马鱼幼鱼与细菌病原体的感染大大提高了我们对发病机制和细胞生物学的理解。 为了突出目前可用的斑马鱼感染模型的广度,我们提供了使用革兰氏阴性细菌(伤寒沙门氏菌、挠性志贺氏菌、铜绿假单胞菌和碳杆菌)、革兰氏阳性细菌(单核细胞增生李斯特菌和金黄色葡萄球菌)和分枝杆菌(马氏分枝杆菌、脓肿分枝杆菌和麻风分枝杆菌)感染的例子)。
二、暴寒沙门氏菌:新陈代谢与炎症之间的新联系
鼠伤寒沙门氏菌是一种重要的人畜共患病病原体,可引起肠胃炎和肠黏膜炎症。向斑马鱼注射伤寒会导致小鼠引起伤寒病,人类引起伤寒病。炎症是沙门氏菌发病机制的关键决定因素,但在感染期间调节炎症的分子机制尚未完全清楚。新的研究报告说,斑马鱼鸟苷酸结合蛋白4(Gbp4)通过激活中性粒细胞中的炎症小体来清除小鼠是必需的。在这种情况下,中性粒细胞通过白三烯的局部释放B4被招募到受感染的组织中,白三烯B4是一种炎症性脂质介质,与C-X-C基序趋化因子配体8(Cxl8)协同实现中性粒细胞的趋化性。招募的中性粒细胞吞噬沙门氏菌并激活GB P4炎症体,调节胞浆磷脂酶A2的活性和前列腺素的产生,支持清除感染。
这些数据表明,炎症小体的激活可用于治疗细菌性疾病,并显示中性粒细胞在体内介导这种反应中的重要作用。
地标研究表明,活性氧(ROS),在氧化磷酸化过程中在线粒体内产生,是杀死细胞内细菌病原体的关键。工作表明,免疫应答基因1(irg1)编码的线粒体定位酶在斑马鱼沙门氏菌感染过程中在巨噬细胞中诱导。巨噬细胞中irg1的耗竭阻止了用脂肪酸促进氧化磷酸化的能力,显著减少了线粒体衍生ROS的产生和杀菌活性(图3A,关键图)。类似的观察也是使用脂多糖(LPS)激活的骨髓来源巨噬细胞进行的,其中Irg1诱导调节线粒体呼吸,并导致代谢转移,影响炎症介质的产生和巨噬细胞效应的功能。这些发现揭示了代谢重新编程和免疫效应器的产生之间的新联系,强调了代谢在宿主防御中发挥的重要作用。
考虑到中性粒细胞是宿主防御的关键,但通常寿命较短,在感染期间消耗的中性粒细胞的补充需要紧急的颗粒发生。使用沙门氏菌-斑马鱼感染模型,已经证明感染过程中中性粒细胞产生增加是造血干祖细胞(HSPC)扩张的直接结果(图3B,B0)。机械地说,这种扩张依赖于巨噬细胞产生粒细胞集落刺激因子(G-CSF),HSPC通过上调诱导型一氧化氮合酶(INOS)对其作出反应)。一氧化氮合酶调节尿素循环产生NO,NO是激活HSPC增殖的多向信号介质。诱导iNOS是由CCAAT/增强子结合蛋白b(C/EBPb)促进的,这是一种转录因子,也参与了哺乳动物中G-CSF依赖的紧急颗粒发生。这些结果描述了一种新的HSPC对感染的反应,并揭示了可以操纵的信号通路来对抗感染和炎症应激。
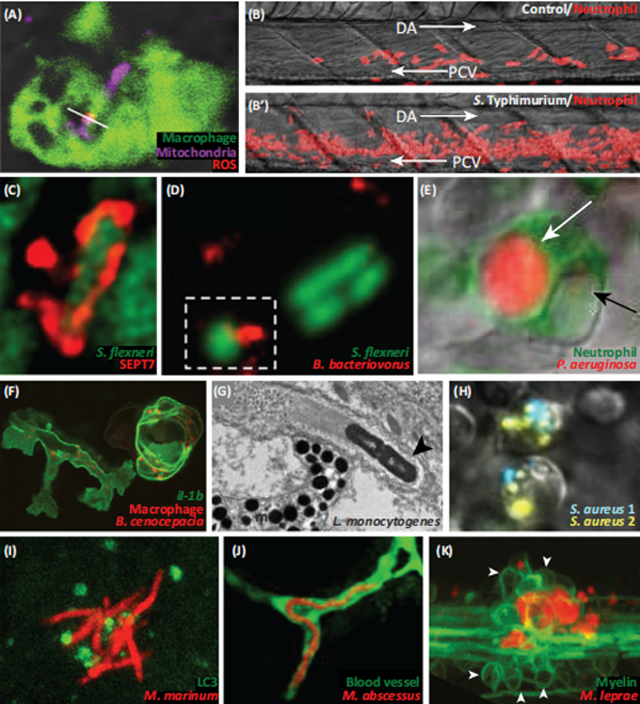
图3 (A)暴寒沙门氏菌感染后,线粒体(追踪器标记)在巨噬细胞(标记为巨噬细胞表达基因1报告者TG)内产生ROS(eGFP)gl22染色)。白线:三跟踪器和混音SOX重叠。对照组(PBS注射)与伤寒沙门氏菌感染斑马鱼幼鱼的紧急粒生反应。 中性粒细胞用溶菌酶c报告TG(Lyz:Ds红色)nz50标记。 箭头:血流方向。 (C)SEPT7免疫标记显示的柔嫩志贺氏菌夹笼。 (D)Bdellovibrio细菌在斑马鱼后脑室捕食Flexneri。用髓过氧化物酶报告Tg(Mpx:eGFP)UWM1标记的中性粒细胞消化铜绿假单胞菌。 白色箭头:含有来自铜绿假单胞菌的强m樱桃信号的空泡。 黑色箭头:空泡,含有来自铜绿假单胞菌的微弱樱桃信号。 (F)巨噬细胞(标记为Tg(Mpeg1:mcherry-F)ump2白细胞介素-1b上调(il-1b标记为Tg(il-1b:eGFP-F))。(G)由肌动蛋白尾巴推动的单核增生李斯特菌(黑色箭头)的电子显微照片。(H)吞噬细胞感染用两种不同颜色(S. aureus 1, S. aureus 2)标记金黄色葡萄球菌。清除接种物会选择少量的持久化物,导致克隆选择。(I)自噬标志物LC3的招募(Tg (CMV:eGFP-LC3)zf155)和海洋分枝杆菌。(J)脓肿分枝杆菌(R型)在血管中呈现细胞外连线(用激酶插入域报告基因Tg标记(kdr:eGFP)s843)。(K)麻风分枝杆菌感染,通过改变轴突髓鞘,加剧神经元损伤(白色箭头:髓鞘,标记为髓鞘碱性蛋白报告蛋白Tg(mbp:eGFP-CAAX))ue2)。缩写:DA,背主动脉;米,载黑素细胞;PCV,后主静脉;ROS,即活性氧。
总之,斑马鱼沙门氏菌感染是发现细胞自主免疫、免疫代谢和紧急粒细胞生成新概念的关键。 此外,这些研究揭示了创新治疗干预的基本先天免疫途径,与多种细菌感染相关。
三、福氏志贺菌:研究活体炎症的一种通用感染范式
志贺氏菌是大肠杆菌引起胃肠道感染和细菌性痢疾的人类病理,是一种以血性腹泻为特征的疾病。 虽然没有非灵长类动物模型存在紧密模拟志贺氏菌病,但可以用斑马鱼检查志贺氏菌感染过程的各种步骤。
当注射到斑马鱼中时,志贺氏菌可以侵入上皮细胞,并诱导人类志贺氏菌的特征,包括炎症和巨噬细胞死亡。 志贺氏菌感染斑马鱼严格依赖于3型分泌系统(T3SS),这是人类疾病所必需的细菌决定因素。 中性粒细胞对宿主防御志贺氏菌具有重要作用,吞噬无法控制感染的细菌和死亡细胞。 从组织培养细胞和斑马鱼的感染中观察到,细胞内志贺氏菌可以逃逸到胞浆中,并被靶向于自噬。为了限制细菌的复制,针对自噬的肌动蛋白聚合细菌被包裹在间隔笼中(图3C)。 在整个动物水平上,自噬的耗竭(通过针对自噬受体p62的吗啡)或刺激(通过雷帕霉素抑制剂雷帕霉素的哺乳动物靶点)都会增加细菌负担和宿主对感染的易感性。 与所描述的自噬在细胞生物学中的作用范围一致,也与使用小鼠研究细菌自噬的文献一致,这些结果表明,自噬需要在体内仔细控制,以防止细菌感染。
志贺氏菌-斑马鱼感染模型有助于发现细胞骨架在细胞免疫中的新作用。 斑马鱼间隔素参与了志贺氏诱导的炎症的限制。 志贺氏菌感染过程中9月15日(哺乳动物9月7日的斑马鱼同源物,对9月7日的间隔功能至关重要)的耗竭导致caspase-1的活性显著增加,宿主细胞死亡,导致严重的中性粒细胞减少和斑马鱼的死亡。 志贺氏菌和9月15日缺乏引起的炎症可以通过使用anakinra来抵消,anakinra是一种抗炎药物,可以阻断白细胞介素-1b(IL-1b)信号传导。 这些发现揭示了间隔素在体内限制炎症信号的重要作用,并提示阿纳金拉可以作为一种治疗方法来限制感染过程中的炎症。
为了遏制耐药性的上升,迫切需要改进和创造性的治疗方法。 布氏杆菌是一种捕食性细菌,因其入侵和杀死其他革兰氏阴性细菌的能力而获得认可。利用一个具有多重耐药菌株的福氏S. flexneri的局部后脑感染模型,我们发现bacillus bacteriovus可以与宿主先天免疫系统协同工作来根除用一线抗生素无法治疗的感染。这些发现证明了捕食性细菌可以在体内作为“活的抗生素”(图3D)。
总之,利用斑马鱼研究志贺氏菌感染提供了我们对自噬和炎症的理解的基本进展,并首次研究了细菌捕食者-食饵在体内相互作用的细胞生物学。 这一信息应为制定新的治疗志贺氏菌和其他多药耐药感染的策略提供重要线索。
四、铜绿假单胞菌:与临床设置相关的病原机制
铜绿假单胞菌是一种机会性细菌,通常感染囊性纤维化(CF)患者的肺部。图示吞噬细胞无法清除气道,导致持续感染的发生。斑马鱼对假单胞菌具有相对的抗性,需要大量接种才能建立感染和杀死宿主。
与人类一样,吞噬细胞的消耗可以显著增加幼鱼对铜绿假单胞菌的敏感性。巨噬细胞和中性粒细胞都可以迅速吞噬并杀死系统输送的细菌,这与吞噬细胞在假单胞菌控制中的关键作用一致(图3E)。
值得注意的是,T3SS突变体在野生型和吞噬细胞缺失型宿主中分别减弱或强毒,这表明假单胞菌在免疫能力强的宿主中的发病机制是由T3SS -吞噬细胞相互作用介导的。与此相一致的是,当巨噬细胞和中性粒细胞同时存在时,假单胞菌T3SS突变体在发育阶段的毒性减弱,但在早期只有巨噬细胞开始出现时是致命的。
在CF患者的肺中,铜绿芽孢杆菌的持续性与通过循环di-GMP实现的生活方式转换(从自由漂浮到生物膜形成)有关。二鸟苷酸环化酶悲伤C在控制铜绿P中环di-GMP水平方面发挥着关键作用,甲基转移酶被确定为悲伤C的相互作用伙伴。悲伤C和A与铜绿杆菌的LPS生物合成机制相互作用,改变LPSO抗原的分布。悲伤的C和战争A突变体在斑马鱼感染期间减弱,因为中性粒细胞招募到突变细菌的显著增加。这些结果证明了悲伤C/战ALPS调节体内免疫逃避的一种新功能。
总的来说,斑马鱼有助于阐明机会性假单胞菌感染背后的发病机制,并作为一个平台来揭示逃避先天免疫所需的细菌效应器。它也可以用来建议新的疗法,旨在增强先天免疫功能来控制机会性细菌感染的人类。
五、小脑壳伯克霍尔德菌:炎症巨噬细胞作为一种复制的生态位
类似于铜绿磷芽孢杆菌, B. 脑软化是CF患者的主要健康问题。在 B. 脑软化感染,细菌使肺初步定植导致脓肿、菌血症和肺功能逐渐下降(称为肺软化综合征),人们普遍认为 B. 细胞软化在CF患者的肺中形成细胞外生物膜,类似于铜绿菌膜形成的生物膜。
然而,研究对这一观点提出了质疑,报道称伯克霍尔德菌寄生在吞噬细胞中,并浸润肺血脑围。为了研究伯克霍尔德菌在体内的致病机制,我们建立了一个小梭菌-斑马鱼感染模型。研究表明斑马鱼幼鱼对该病毒高度敏感ET12株洋葱芽孢杆菌(一种在人类和其他动物模型中高毒的临床分离株),但可以耐受洋葱芽孢杆菌复合体弱毒成员的感染,包括越南伯克霍尔德菌和稳定伯克霍尔德菌。
尽管巨噬细胞和中性粒细胞已被观察到与注射到斑马鱼体内的伯克霍尔德菌相互作用,但巨噬细胞对于cenocepacia的存活和体内复制是必不可少的。相反,中性粒细胞不影响细菌复制或疾病结局。与巨噬细胞在伯克霍尔德菌感染中的关键作用一致,化学消融巨噬细胞显著降低了细菌的复制和宿主对感染的敏感性。伯克霍尔德菌的巨噬细胞内复制是由慢性疾病转变为急性疾病的基础,其特征是炎症和斑马鱼死亡。与此相一致的是,巨噬细胞是伯克霍尔德菌感染期间Il-1b的主要来源(图3F)。然而,炎症在介导伯克霍尔德菌耐药性或易感性中的作用尚不清楚:Il-1b的减少是细菌性的,而anakinra对Il-1b信号的调节是抗菌的。斑马鱼模型的进一步应用对于在体内破译炎症在伯克霍尔德菌发病机制中的确切作用具有重要意义。
总之,这些结果表明巨噬细胞,而不是中性粒细胞,对毛胚芽肿的复制和炎症是至关重要的。因此,斑马鱼感染可作为体外模型和临床研究的补充,并可用于研究伯克霍尔德菌体内发病机制。
六、单核增生李斯特菌:了解宿主对胞质细菌防御的进展
单核细胞增多性乳杆菌是一种食源性病原体,在受感染者中引起多种症状,从发烧到危及生命的败血症。李斯特菌的两个主要毒力因子包括lysteriolisin O (LLO),一种能从内化液泡中逃逸的形成孔隙的毒素,和ActA,一种模仿肌动蛋白成核因子黄蜂(Wiskott-Aldrich综合症蛋白)的细菌,它聚合肌动蛋白尾部以逃避细胞免疫。斑马鱼注射表明血源性李斯特菌被巨噬细胞和中性粒细胞[35]迅速吞噬。在斑马鱼中可以观察到LLO依赖的液泡逃逸和actin依赖的肌动蛋白尾巴的形成,其中LLO和ActA突变体减弱。这些观察结果证明了李斯特菌感染的特征在体内的相关性(图3G)。
单增生L.菌株经工程改造后能异位分泌嗜肺军团菌鞭毛蛋白单体(称为Lm-pyro),已被用于证明炎性小体激活在宿主防御中的作用。研究表明,无论是在体外使用骨髓来源的巨噬细胞还是在体内使用小鼠,Lm-pyro激活炎性小体并减弱(与野生型李斯特菌相比)。同样,在斑马鱼感染过程中,Lm-pyro可以激活巨噬细胞中的炎性小体,导致体内的衰减。与炎症小体在宿主防御中的作用一致,巨噬细胞的消耗或caspase-1同源斑马鱼恢复Lm-pyro菌株的毒性。
李斯特菌如何与细胞质膜相互作用目前还不完全清楚。GP96是一种内质网伴侣,在暴露于LLO后参与质膜起泡。膜泡的形成可以作为宿主防御机制,保护宿主细胞裂解介导的孔形成毒素。利用组织培养细胞和斑马鱼的研究表明,GP96可以与非肌肉肌球蛋白重链IIA相互作用,控制水泡的形成。因此,GP96在细胞骨架组织、细胞迁移和质膜完整性。与GP96在保护机体免受llo依赖杀伤的作用一致,GP96在李斯特菌感染过程中体内耗损显著降低了斑马鱼的存活率。
总的来说,斑马鱼的感染有助于突出单核细胞增生L.作为细胞微生物学和细菌-吞噬细胞相互作用的体内研究范式。可以预测,未来利用斑马鱼感染李斯特菌的研究将阐明宿主对胞质细菌防御的基本原理。
七、金黄色葡萄球菌:中性粒细胞作为免疫瓶颈
金黄色葡萄球菌是人类皮肤和粘膜菌群的常见成员,但在住院环境中可引起各种并发症,包括脓肿、肺炎和败血症。通过在血中注射细菌,斑马鱼也可以观察到由金黄色葡萄球菌引起的脓肿和败血症。金黄色葡萄球菌被认为是一种细胞外病原体,然而,使用金黄色葡萄球菌-斑马鱼感染模型的工作揭示了金黄色葡萄球菌在体内的重要细胞内生命周期。斑马鱼全身感染后,巨噬细胞和中性粒细胞清除了注射的金黄色葡萄球菌的大部分,但很少有能够避开吞噬细胞杀伤的持久性细菌能够存活并复制(图3H)。
这种情况造成了免疫瓶颈,导致克隆选择。中性粒细胞是细菌克隆选择发生的主要复制生态位,中性粒细胞的缺失会显著减少克隆选择。金黄色葡萄球菌因产生抗生素耐药性而臭名昭著,在斑马鱼或小鼠身上使用亚治疗剂量的抗生素,可以使体内的耐抗生素克隆提前扩展。这一现象可以用金黄色葡萄球菌感染的吞噬细胞依赖性克隆选择特性来解释。
斑马鱼金黄色葡萄球菌感染有助于发现神经生长因子b (NGFb)在先天免疫中的作用。从无脊椎动物到脊椎动物,先天免疫因子并不总是保守的,而果蝇Toll配体spetzle被认为缺乏与之对应的脊椎动物。
然而,存在于脊索动物中的NGFb在结构上与果蝇大虾相似,并在针对金黄色葡萄球菌的免疫应答中发挥大虾样功能。通过识别金黄色葡萄球菌外显蛋白激活NOD-like受体(NLRs),巨噬细胞释放NGFb并刺激细菌杀死。NGFb或其高亲和性催化受体原肌球蛋白受体激酶A (TRKA)的突变与人类金黄色葡萄球菌感染的严重程度增加有关。TrkA缺失的斑马鱼也显示出对金黄色葡萄球菌感染的敏感性增加,支持NGFb - TrkA轴在宿主防御中的进化保守作用。
总之,斑马鱼金黄色葡萄球菌感染揭示了抗葡萄球菌免疫的进化保守成分,以及细菌持久性的基本机制。这些结果对设计新的治疗策略有广泛的意义,可以有效地限制疾病结果和抗菌素耐药菌株的选择。
八、海洋分枝杆菌:免疫逃避的建筑师
海洋分枝杆菌(M. marinum)与结核分枝杆菌(人类结核病的病原体)密切相关,是一种水生物种的自然病原体,包括变形虫、无脊椎动物、两栖动物和鱼类。因此,斑马鱼的M. marine inum感染已成为研究的主题,并被用于发现人类结核病的基本机制。
在斑马鱼感染M.马林菌的开创性工作提供了范例有证据表明,分支杆菌肉芽肿是巨噬细胞对毒性决定区差异1 (RD1)的反应引发的,并不严格要求适应性免疫应答。巨噬细胞在肉芽肿的发生中起重要作用,而中性粒细胞则没有。相反,在晚期和炎症阶段,中性粒细胞被招募到肉芽肿聚集物中,参与清除坏死巨噬细胞中的细菌和碎片。炎症状态是建立分枝杆菌感染的关键。对斑马鱼的正向遗传筛选揭示了促炎酶白三烯A4水解酶(Lta4h)在分枝杆菌易感性中的关键作用,这一发现也在人类中观察到。此外,肿瘤坏死因子(TNF)的水平对分枝杆菌的限制很重要,因为TNF控制巨噬细胞ROS的产生。在这种情况下,巨噬细胞中TNF/ROS的低水平或高水平分别会降低杀微生物活性或导致细胞死亡。
巨噬细胞在海洋M.感染期间的作用是复杂的。巨噬细胞的耗竭、髓系生长因子的失调或巨噬细胞充盈未消化的内容物(如溶酶体储存障碍)都导致无法控制细菌在体内的复制。
相比之下,减少巨噬细胞向肉芽肿聚集可以限制细菌的扩散和肉芽肿的扩张。与此一致的是,使用小鼠模型进行的研究表明,巨噬细胞的减少(但不是完全消融)对M. tuberculosis感染有保护作用。巨噬细胞的激活状态对于分枝杆菌的控制是至关重要的,通过分枝杆菌表面脂质的进化,可以掩盖病原体相关的分子模式,以避免巨噬细胞识别。驻留在组织中的巨噬细胞首先对感染作出反应,并能消灭细菌。
然而,从循环中招募的单核细胞与感染的巨噬细胞和分枝杆菌融合,被转移到一个更允许的生态位。单核细胞招募依赖于宿主巨噬细胞的感染,需要识别细菌酚糖脂,通过干扰素基因刺激器(STING)进行胞浆感应,并表达C-C基序趋化因子配体2 (Ccl2),这是一种有效的单核细胞趋化剂。
虽然M. marinum在感染早期可以避免toll样受体(TLR)识别,但TLR信号在后期和更严重的炎症阶段中介导抗细菌自噬是至关重要的(图3I)。巨噬细胞利用吞噬溶酶体的成熟来杀死分枝杆菌,然而,由于MarP(一种能够耐酸的毒力因子)的作用,M. marinum可以在这些腔室中缓慢复制。值得注意的是,在对M. marinum感染的反应中,巨噬细胞被重新编程,上调上皮细胞标记物,并经历以肉芽肿内形成紧密连接为特征的间充质向上皮细胞过渡。虽然这个过程可以限制细菌的传播,但它也阻碍了新招募的免疫细胞进入肉芽肿核心。通过缺氧诱导,巨噬细胞激活促血管生成程序,促进肉芽肿扩张和细菌生长。与此相一致的是,抗血管生成治疗已被证明可减弱肉芽肿的形成。
总之,天然鱼类病原M. marinum的感染为人类结核提供了多种新的见解,从根本上改变了我们对结核肉芽肿的理解,并为对抗人类结核提供了新的治疗途径。此外,斑马鱼的M. marine inum感染可以反映人类结核病患者发病机制的异质性,从而在体内评估危险因素和个性化的抗菌药物方案。
九、脓肿分枝杆菌:新兴细菌威胁的病毒的发光机制
脓肿分枝杆菌复合体是一组快速生长的分枝杆菌,常与创伤后脓毒症和脆弱宿主感染相关。治疗是具有挑战性的,部分原因是脓肿分枝杆菌对许多抗生素具有耐药性。脓肿分枝杆菌可以从表达细胞表面糖肽脂的光滑(S)型转变为无糖肽脂且临床上毒性更强的粗糙(R)型。使用斑马鱼感染模型,比较了S型和R型的致病性。
研究发现,S型的衰减可归因于其缺乏连线,而连线是R型防止吞噬和启动脓肿形成的必要特征(图3J)。一项后续研究确定了一种细菌脱水酶(MAB_4780)在体内介导编码是必不可少的。这种酶的基因突变不能形成细胞外索,并且在野生型和免疫缺陷幼鱼中毒性减弱。
控制脓肿分枝杆菌感染需要激活TNF信号,而TNF受体1 (Tnfr1)的缺失可增加对S型和R型的敏感性。与海洋分枝杆菌感染的发现一致,TNF信号的缺失降低了巨噬细胞的杀微生物活性和中性粒细胞的招募到脓肿分枝杆菌感染的病灶,导致不受限制的细菌生长。这些观察结果与抗tnf治疗促进脓肿分枝杆菌感染的证据一致。
这些结果表明细菌黏结是脓肿分枝杆菌免疫逃逸的重要机制,提示抑制黏结可以在体内预防脓肿分枝杆菌的发病。此外,斑马鱼感染有助于解释为什么免疫抑制TNF治疗会导致人类脓肿分枝杆菌感染的加剧。
十、麻风分枝杆菌:麻风巨噬细胞的新作用
麻风病是麻风病的病原体,麻风病是一种衰弱性疾病,其特征是周围神经系统的损害。由于细菌在无菌条件下无法培养,对麻风病的了解仍然很低,而且动物感染模型仅限于老鼠脚掌或九带犰狳(Dasypus novemcinctus,一种自然感染宿主)。
麻风杆菌的发病主要归因于病原菌引起轴突脱髓鞘的能力,从而导致周围神经病变,但如何触发轴突脱髓鞘的麻风杆菌还没有完全明确。当麻风杆菌被注射到斑马鱼体内时,麻风杆菌与巨噬细胞相互作用,穿过血管内皮并侵入外周组织,在那里它可以形成与麻风杆菌诱导的肉芽肿类似的肉芽肿。麻风M.,而不是海洋M.,可触发脱髓鞘和外周轴突损伤与麻风M.酚糖脂-1 (PGL-1)的表达相关(图3K)。与此相一致的是,表达M. leprae PGL-1的M. marinum也在体内触发脱髓鞘。值得注意的是,PGL-1本身并不使轴突脱髓鞘。相反,巨噬细胞介导神经元损伤,麻风杆菌无法在巨噬细胞减少的宿主中触发脱髓鞘。用表达麻风M. PGL-1的M. marinum感染巨噬细胞,结果显示巨噬细胞上调iNOS导致轴突损伤,用iNOS抑制剂治疗可以显著减少巨噬细胞诱导的轴突损伤。
引人注目的是,斑马鱼幼鱼感染麻风病为研究周围神经病变(麻风病感染的一个标志)提供了一个有价值的系统,并揭示了巨噬细胞和亚硝基应激在介导疾病结果中的新作用。斑马鱼感染麻风杆菌模型还强调了斑马鱼在研究被忽视疾病的宿主-病原体相互作用方面的潜力。
十一、结论
我们阐述了斑马鱼细菌感染模型如何揭示感染生物学的关键方面,并为理解细胞免疫生物学提供了基础进展。可以预期的是,利用斑马鱼对宿主-病原体相互作用的研究将继续阐明包括人类在内的高等脊椎动物细菌感染的复杂性。
考虑到目前可用的其他动物模型,斑马鱼感染生物学研究的未来是什么(见突出问题)?斑马鱼感染的全部潜力尚未被认识到,而先进的基因编辑和高分辨率显微镜技术的应用将进一步促进这一模型更好地理解发病机制和基本的细胞过程。
是什么决定了斑马鱼感染模型的有用程度?显然,斑马鱼感染模型的关键优势在于它的多功能性和快速发现能力。我们预测这些特性将是有价值的研究细胞生物学的新兴和被忽视的病原体在体内,并发现不可预见的方面的宿主-病原体界面。如何利用斑马鱼感染进行临床应用?斑马鱼模型越来越多地用于临床前药物开发和毒性测试,而使用M. marinum进行的工作已成为斑马鱼如何用于开发治疗干预的首要例子。
为了深入了解分子机制和途径,利用组织培养细胞的体外模型与利用斑马鱼的体内模型互补是至关重要的。一个主要的问题是使用更高的脊椎动物模型(包括小鼠)来验证斑马鱼感染过程中发现的分子和细胞事件。这一信息也将为开发新的治疗人类传染病的策略提供重要线索。
参考资料:
[1] Lieschke, G.J. and Currie, P.D. (2007) Animal models of human disease: zebrafish swim into view. Nat. Rev. Genet. 8, 353–367
[2] Streisinger, G. et al. (1981) Production of clones of homozygous diploid zebra fish (Brachydanio rerio). Nature 291, 293–296
[3] Stuart, G.W. et al. (1988) Replication, integration and stable germ-line transmission of foreign sequences injected into early zebrafish embryos. Development 103, 403–412