
NEWS
新闻中心
SERVERS
服务项目
NEWS
最新资讯
发布时间:2021-06-15
炎症小体激活和造血之间的关系已被提出用于几种医疗条件;例如,造血系统偏向与慢性炎症疾病有关。
然而,其机制和信号通路尚不清楚。这方面的第一批证据之一是证明了人的GATA1在体外可以被许多caspases切割,而在人的红细胞前体中可以被caspase-3在体内切割。
此外,在小鼠HSPCs中Nlrp1a的激活引发了这些细胞的热解死亡和白细胞减少,而在化疗或病毒感染诱导的造血应激期间,Nlrp1a的激活导致了长时间的细胞减少、骨髓发育不全和免疫抑制。此外,在嘌呤能信号、补体激活和G-CSF给药过程中,theNLRP3炎症小体对于从BM中释放小鼠热休克蛋白是必需的。
值得注意的是,小鼠移植实验表明,NLRP3敲除,无论是在HSPCs中还是在BM基质细胞中,都会导致HSPC的归位和移植受损。
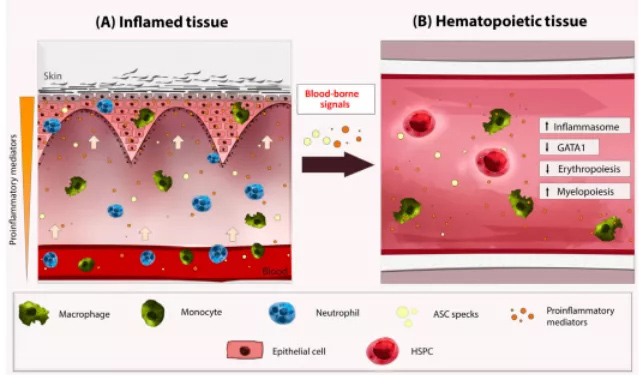
此外,已发现NLRP3炎性小体在骨髓增生异常综合征患者中驱动克隆扩增和细胞焦亡。因此,已经证明,虽然典型炎性小体对于斑马鱼幼鱼HSPC的出现是必不可少的,但它在两个不同的水平的稳态条件下自主调节HSPC的分化:红髓细胞命运决定和终末红髓分化。
因此,不同炎性小体的遗传抑制作用,例如Gbp4[Tg(uas:gpb4)]或ASC Tg(uas:ascΔCARD eGFP)和caspase a(Caspa)的药理学抑制(斑马鱼的功能相当于哺乳动物的CASP1)导致中性粒细胞和巨噬细胞数量减少,同时伴随着幼鱼红细胞数目的增加反之,通过mRNA注射强制同时表达ASC和Caspa,增加了中性粒细胞数量。
用甲硝唑前药对中性粒细胞表达细菌硝基还原酶的幼鱼进行中性粒细胞消融实验,进一步证实了上述结果;其中caspase-1 Caspa的药理抑制完全损害了消蚀后中性粒细胞的恢复。进一步分析显示Tg(runx1:GAL4)中HSPC的出现未受影响,提示炎性小体可调控HSPC分化。
机制上,炎性小体激活HSPCs导致Gata1蛋白数量减少,促进骨髓生成,抑制红细胞生成。这一机制似乎在进化上是保守的,因为来自SPI1 eYFP和GATA1 mCherry的报告小鼠的HSCs中CASP1的药理学抑制迅速增加了GATA1蛋白量,而不影响SPI1的蛋白量,导致以髓系分化为代价的红系分化增加(图1)。
此外,人红白血病系K562的红系分化也因抑制CASP1而受损,但CASP4不受影响,这表明典型炎性小体通过抑制GATA1蛋白的数量在红系末端分化中发挥作用。体外实验证实了重组人CASP1能够在D300残基处切割GATA1。
综上所述,这些结果支持了这样一种假设,即在HSPCs中,GATA1蛋白的数量由典型炎性小体微调,以调节红髓决定,同时在红髓祖细胞中,调节其终末分化。