
NEWS
新闻中心
SERVERS
服务项目
发布时间:2024-06-20

编者按
Yes相关蛋白(YAP)是Hippo信号通路中的转录下游调控靶标,通过限制增殖和促进细胞凋亡在器官大小控制和肿瘤抑制中发挥关键作用。然而,关于YAP如何影响循环中肿瘤细胞的行为,目前知之甚少。
2021年3月,麻省理工学院科赫综合癌症研究所研究团队在HHS Public Access上发表了最新研究成果,该研究利用斑马鱼系统快速测试已知促进小鼠转移的基因如何影响循环中肿瘤细胞的行为,几乎在所有癌症中都观察到YAP活性增加。除了促进肿瘤生长和进展外,YAP 还被证明可以促进多种肿瘤类型的转移,并通过实验表明YAP还可以增强在哺乳动物系统中的传播,揭示了一种影响动物体内肿瘤细胞分布的新机制。
文章题目
YAP Enhances Tumor Cell Dissemination by Promoting Intravascular Motility and Re-entry into Systemic Circulation
杂志:《HHS Public Access》
发表时间:2021.3
作者:Scott R. Manalis,Richard O. Hynes等
单位:麻省理工学院
10.115810008-5472.CAN-20-0212.
01、研究背景
转移包括一系列复杂的级联事件,最终导致远处位置出现新肿瘤。先前的研究表明,当肿瘤细胞穿过循环系统、在未来的转移部位停留、外渗并生长成新肿瘤时,可能会发生转移的限速步骤,这表明了解这些步骤的重要性。
然而,这些步骤的研究可能具有挑战性,因为它们是高度动态的。在循环中,转移细胞可以以每秒数百微米的速度行进,遇到各种物理和化学压力,并与不同的血细胞发生短暂的相互作用。鉴于这些事件的复杂性和动态性,需要活体成像来充分阐明它们。
本研究中使用斑马鱼系统快速测试已知促进小鼠转移的基因如何影响循环中肿瘤细胞的行为。几乎在所有人类癌症中都观察到 YAP活性增加。除了促进肿瘤生长和进展外,YAP 还被证明可以促进多种肿瘤类型的转移。然而,关于 YAP 如何影响循环中肿瘤细胞的行为,人们知之甚少。
研究者发现,虽然对照组细胞仍被困在遇到的第一个毛细血管床中,但表达活性 YAP 的细胞能够穿过这些血管,这使它们能够继续通过体循环并更广泛地传播。这种通过小血管移动的能力的增强似乎是由于血管内运动的增强。静脉注射到小鼠体内后,YAP 细胞在循环中的停留时间也更长,这表明YAP还可以增强在哺乳动物系统中的传播。此项发现揭示了一种影响动物体内肿瘤细胞分布的新机制。
02、研究结果
1、斑马鱼胚胎的转移测定
研究者为了研究循环中和转移部位的肿瘤细胞,通过居维叶导管将细胞直接注射到2dpf斑马鱼胚胎的循环中。可发现注射后大多数肿瘤细胞位于尾部,而少数细胞位于胚胎的大脑中。研究者认为,大脑可能是寻找增强转移的好位置。注射后4天检测转移情况,以便细胞在成像前有时间在脑内外渗和增殖。
通过根据肿瘤细胞核占据的脑细胞面积百分比计算,只有YAP-AA导致脑肿瘤细胞负荷增加,促进了脑瘤整体尺寸和数量的增加。
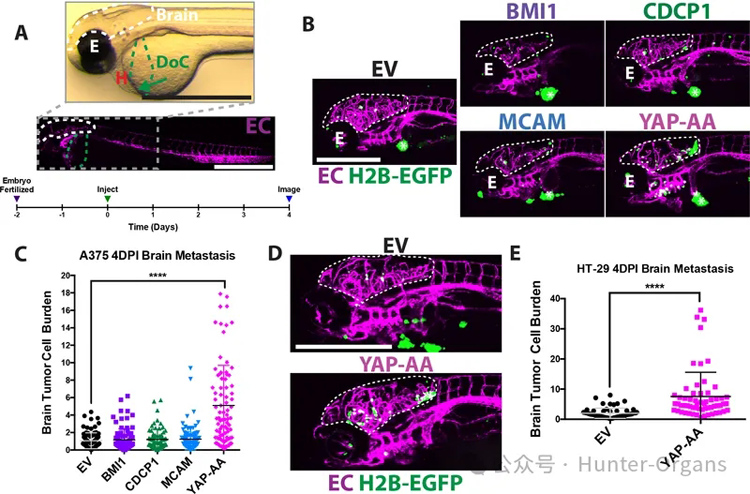
图1
2、YAP-AA 注射后 10 小时促进脑转移
YAP调节许多可能影响转移的特性,包括增殖、存活和外渗(20,22,32)。为了确定YAP-AA是如何促进转移的,研究者首先研究了YAP-AA何时促进转移。结果发现YAP-AA增强转移发生在注射后10小时内。
为了研究这些过程,研究者利用了对幼鱼进行延时成像的能力。观察到细胞在脑血管系统内同一位置停留的时间被用来作为逮捕的替代指标。总的来说,结果表明YAP-AA并不是通过显著增强该系统的停搏、外渗、循环存活或增殖来促进脑转移的。
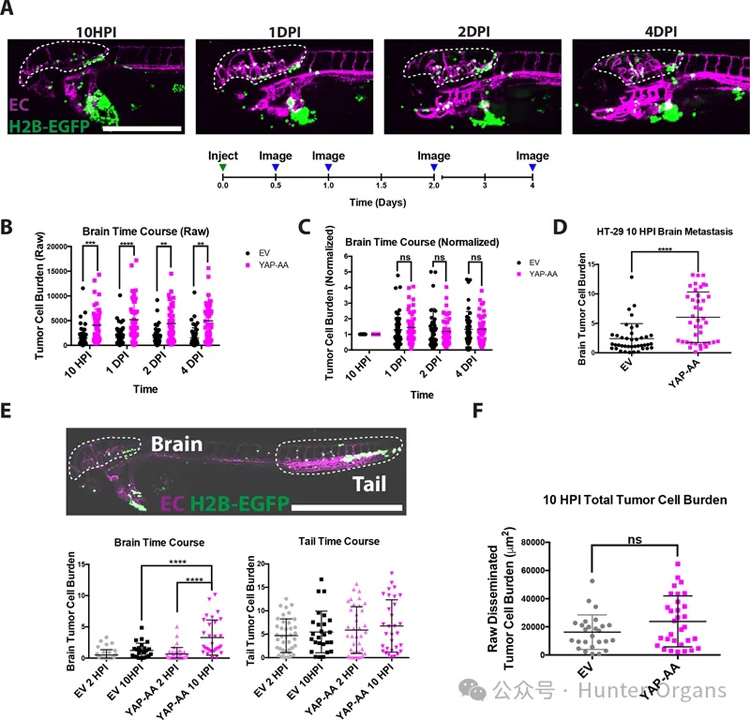
图2
3、YAP-AA促进肿瘤细胞在短暂停止后重新进入循环
研究者还观察到,在注射后数小时内,似乎有更多的YAP-AA细胞进入大脑。当大脑中的细胞随着时间的推移被定量,在头10个小时内观察到YAP-AA细胞的稳定流入,而很少看到控制组到达。在2.5个小时内,大脑中的YAP-AA细胞数量显著增加,而YAP-AA和 细胞之间的这种增加随着时间的推移而继续增加。
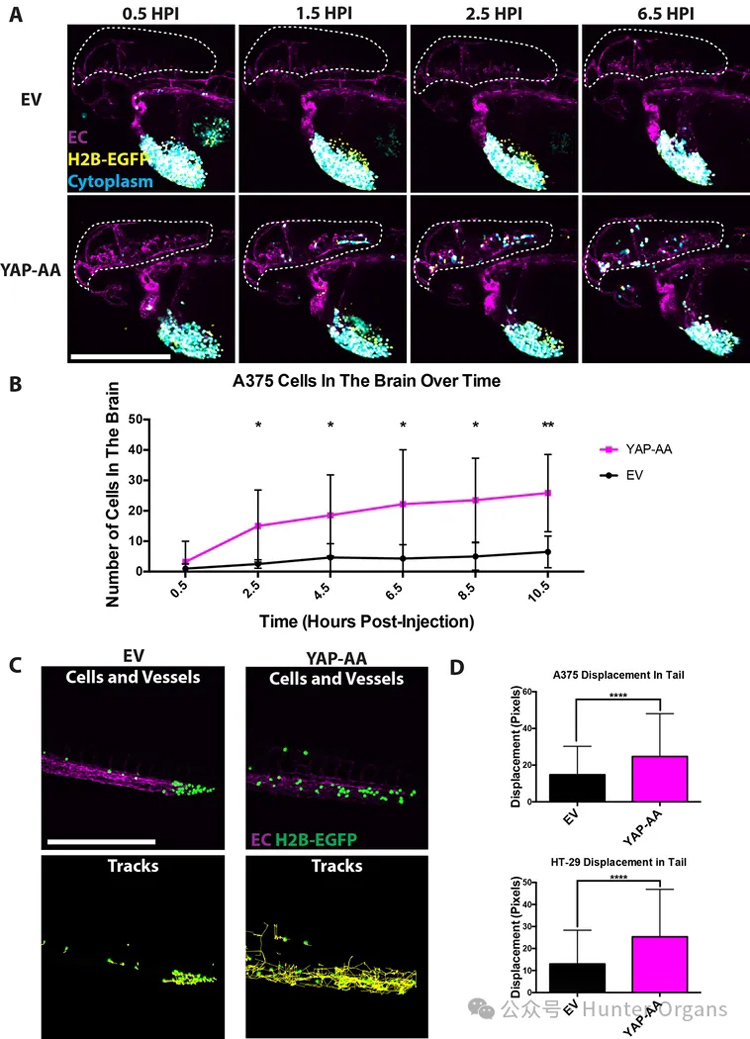
图3
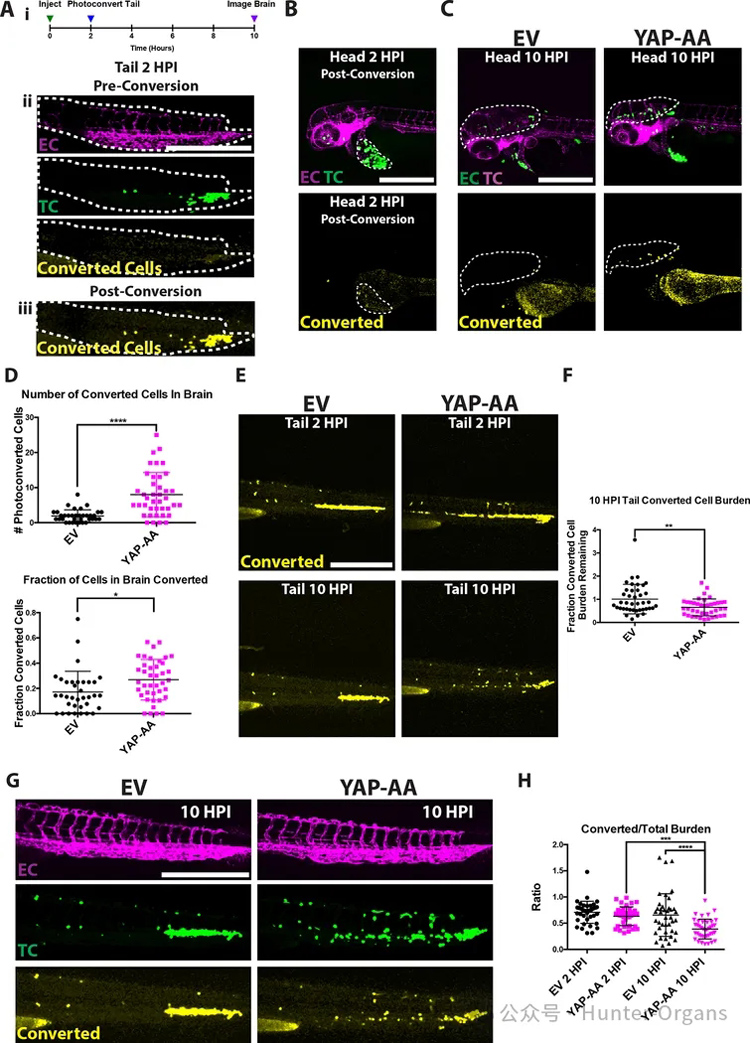
图4
4、YAP-AA促进血管内迁移,从而使被抑制的肿瘤细胞能够取出并重新进入系统循环
研究者假设,YAP-AA可能是通过降低细胞细胞粘附、增强变形性或增强主动迁移来实现的。结果表明,YAP并没有降低细胞细胞粘附。然后接下来研究了在血管系统内主动迁移的可能性,实验表明几乎所有的控制对照组在同一个位置。
然而,YAP-AA细胞在血管内动态伸展并移动,YAP-AA细胞似乎也会迁移到头部较小的血管中,而EV细胞则会随着时间的推移而保持在同一位置,这表明这种迁移依赖于YAP,而不是血管组织的结构。总的来说,从斑马鱼的研究结果表明,YAP-AA可以促进肿瘤细胞的传播,促进通过狭窄的毛细血管床的主动迁移,以控制细胞。这种迁移使得YAP-AA细胞能够重新进入系统循环,并在下游器官中产生额外的种子。
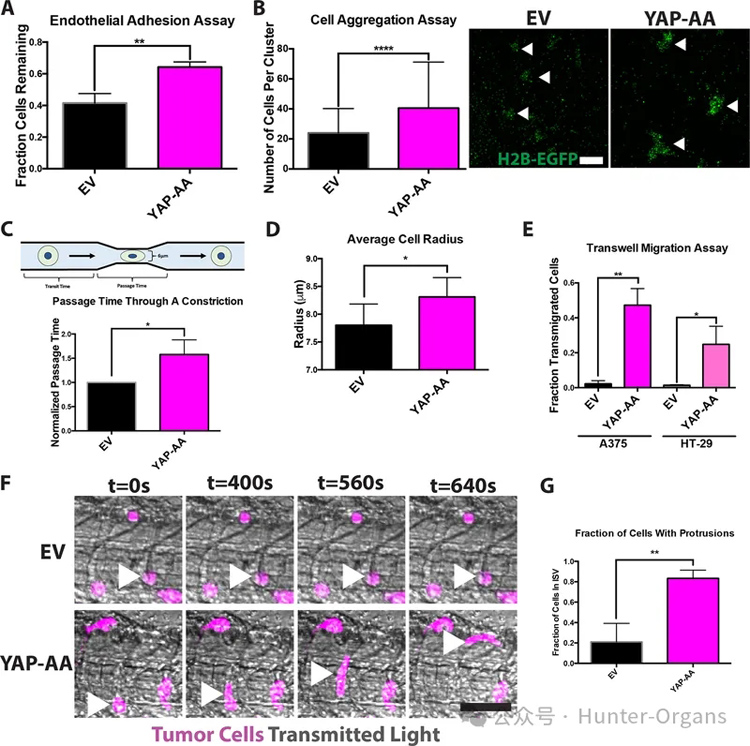
图5
5、YAP 通过 TEAD 介导的转录推动传播
研究者通过基因编辑技术构建突变体,测试了YAP-AA促进转移是否是一个细胞自主的过程。对照A375细胞和YAP-AA细胞分别表达Cerulean(青色)和iRFP670(黄色)。对照细胞和YAP-AA细胞分别或按1:1比例混合注射到斑马鱼胚胎中。当共注射时,YAP-AA细胞在注射后4天表现出脑转移增强。共注射并未增强EV细胞的转移,表明YAP对转移的增强作用仅限于YAP-AA细胞。
这些结果表明,YAP通过细胞自主机制促进传播,而不依赖于细胞外信号分子。
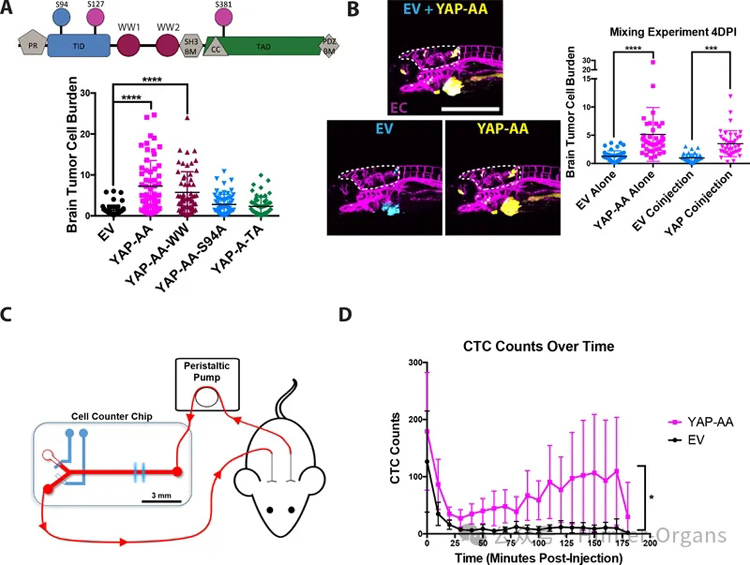
图6
6、YAP-AA增加小鼠循环肿瘤细胞
为了探索斑马鱼的结果是否可以在哺乳动物系统中复制。通过随时间跟踪血液中荧光标记的ctc的数量。观察到,随着时间的推移,与对照细胞相比,循环中的YAP-AA细胞明显增多。此外,虽然EV ctc的数量迅速下降,但YAP-AA细胞的数量在注射后25至175分钟内开始下降,但缓慢增加。
这种趋势与斑马鱼的研究结果一致,斑马鱼的YAP-AA细胞最初停留在小毛细血管中,随着时间的推移慢慢重新进入体循环。这些结果表明,YAP可以增加肿瘤细胞在哺乳动物系统中循环的时间。这种循环时间的增加可以使这些肿瘤细胞在动物体内传播得比对照细胞更广泛,对照细胞大多被困在它们遇到的最早的毛细血管床中。
03、编者点评
综上,本研究表明YAP-AA促进斑马鱼胚胎的脑转移。通过延时成像,我们能够评估 YAP-AA 对停滞、外渗、循环存活和穿过脉管系统的影响,以确定它如何促进该系统中的转移。虽然对照细胞在遇到的第一个毛细血管床中停滞并保留在那里,但 YAP-AA 诱导肿瘤细胞迁移通过这些血管并重新进入循环,导致更广泛的扩散和转移形成。我们在小鼠中的结果与这些结果一致,表明 YAP 也可以增强哺乳动物中的广泛传播。
作为健康美丽产业CRO服务开拓者与引领者、斑马鱼生物技术的全球领导者,环特生物搭建了“斑马鱼、类器官、哺乳动物、人体”四位一体的综合技术服务体系,开展健康美丽CRO服务、科研服务、智慧实验室搭建三大业务。目前,环特已建立200多种斑马鱼模型及脑类器官、心脏类器官及各种肿瘤类器官培养平台,欢迎有需要的读者垂询!