
NEWS
新闻中心
SERVERS
服务项目
NEWS
最新资讯
发布时间:2021-09-10
核心摘要
哺乳动物模型(包括非人类灵长类动物、猪和啮齿动物在内)已被广泛用于研究心脏疾病的机制。然而,越来越多的人希望替代性模型系统能够在替代或减少哺乳动物使用的同时提供卓越的科学价值。
在这里,我们回顾了斑马鱼在心脏疾病上的研究。我们比较了斑马鱼和哺乳动物心血管系统的解剖学和生理学,并描述了斑马鱼模型在研究心脏机制(例如:先天性心脏缺陷、心肌病、传导障碍和再生),并描述了斑马鱼的几个特征,使其成为治疗心脏疾病的体内筛选化合物的令人信服的模型。

一、引言
这篇综述的目的是对斑马鱼心脏疾病模型的使用进行概述。我们比较了斑马鱼和哺乳动物系统的解剖学和生理学,并总结了斑马鱼的心脏病理模型,重点是先天性心脏缺陷,心肌病,传导障碍和再生。
二、斑马鱼与哺乳动物:生理学上的比较
由于它们只有一个循环系统,斑马鱼有一个由一个心房和一个心室组成的两室心脏,通过调节血压的动脉球连接到鳃血管系统。成年斑马鱼心脏除了缺乏室间隔和存在硬骨鱼特异性的球形动脉外,与吸热脊椎动物心脏相比,它的心脏也是高度小梁化的,心室壁的致密心肌相对较少。
尽管与哺乳动物相比,斑马鱼心脏相对简单,但大多数特殊的细胞类型和结构(如起搏器、房室瓣、主动脉瓣、小梁和冠状血管)和起作用的细胞类型(心肌、心内膜、心外膜、心脏神经嵴、第二心野和成纤维细胞)都保留着。类似地,信号传导通路和驱动早期心脏发育的形态发生过程也被很好地保留着,斑马鱼现在被广泛用作研究心脏发育和形态发生的模型。
斑马鱼越来越多地用于分析心脏功能障碍。斑马鱼的心率比其他模式生物的心率更类似于人类,成年斑马鱼的心电图分析识别出清晰的P、QRS和T波,QT持续时间表明复极时间相当,证明成年斑马鱼心脏的电生理与人类高度相似。尽管胚胎斑马鱼心脏很小,但已经开发了测量胚胎心电图谱的技术,从受精后3天(dpf)开始识别与在成年斑马鱼中观察到的相似的心电图特征。由于斑马鱼是变温动物,这些电生理动力学取决于温度,因此,斑马鱼心脏电活动的比较分析是受温度控制的,这一点很重要。
斑马鱼和人类心脏之间ECG活动的相似性,特别是不同的 QT 间期,是由于高度可比的心室动作电位(AP),斑马鱼和人类在复极期间在正电压下都表现出长平台期。许多控制人类AP动力学的关键离子通道在斑马鱼中都有直系同源物,例如,由SCN5A编码的Na+通道,内向整流器 IK,ACh K+通道由KCNJ3和KCNJ5编码,外向整流IKr K+通道由KCNH2编码。然而,人类和斑马鱼AP动力学和通道组成或功能之间也存在关键差异,物种之间的心房AP不太相似,内向整流器IK1通道的组成不同,并且没有延迟整流电流I Ks编码基因。尽管这些相似之处使斑马鱼成为了解人类心脏电生理学的非常合适的模型,但在药理分析期间应牢记离子通道组成的变化和AP动力学的细微差异。
三、斑马鱼心脏疾病模型
斑马鱼已被用于模拟心脏发育、功能和疾病的许多方面。在这里,我们重点介绍了斑马鱼对我们对心脏缺陷的理解做出了重大贡献的具体例子,以及用于生成和询问这些模型的遗传和实验技术。
先天性心脏缺陷(CHD)是常见的出生缺陷,包括一系列结构畸形,包括间隔缺陷、流入和流出道畸形、腔室发育不全和瓣膜发育不全等。尽管与具有双循环系统的哺乳动物的四腔心脏相比,斑马鱼的两腔心脏相对简单,但斑马鱼心脏发育的分子调控和形态发生过程是高度保守的。在这里,我们重点介绍斑马鱼为CHD病因提供新见解的具体例子。
异位症综合征是由胚胎发生过程中身体左右模式的扰动引起的,导致器官侧化的一致性丧失和器官系统内部不对称的破坏。心脏是高度不对称的器官,正确的不对称形态发生对于正确的心脏功能至关重要。因此,异位性个体经常出现 CHD。调节胚胎不对称早期建立的途径中的关键参与者已经确立,斑马鱼突变体表现出与同源基因突变患者相似的异性表型(图 1)。
近来的研究在候选基因中发现了可能导致异性恋的新变异,通过CRISPR-Cas9 介导的胚胎诱变进行功能验证,确认dnah10、rnf115、flna、kif7和kmt2d可调节心脏不对称。斑马鱼突变模型还阐明了携带CFAP53突变的个体CHD的潜在机制,编码纤毛蛋白。CHD表型的遗传学是复杂的,这突出了斑马鱼在剖析心脏形态发生基础的通路和相互作用方面的价值。
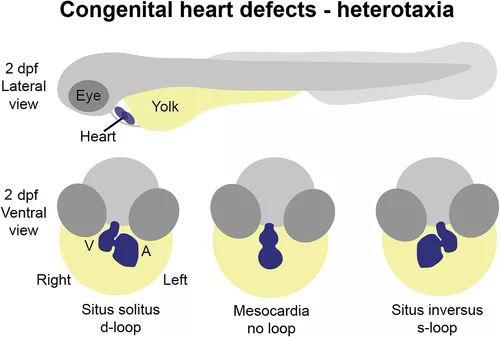
图1 先天性心脏缺陷的斑马鱼模型。斑马鱼的先天性心脏缺陷通常在 2 dpf 时进行分析,此时心脏已经历初始循环形态发生并位于蛋黄上方、腹侧和头部后方。可以区分心房 (A) 和心室 (V) 的形态,并且可以看到房室管和流出道。异位性表型可以通过心脏环状形态的方向性来评估,心脏通常在正常左右模式下经历d环(原位),但可以反转(s环)或保持在中线(无环)如果胚胎侧向性被破坏。
斑马鱼是研究环境因素对心脏发育影响的绝佳模型。PM2.5是细颗粒物,在空气质量差或污染严重的城市地区发现了高水平的颗粒物。PM2.5与CHD发病率增加有关,斑马鱼胚胎暴露于PM2.5会导致发育性心脏缺陷,包括心脏畸形和心动过缓。
该模型已被用于识别可改善PM2.5对心脏影响的化合物,例如叶酸。叶酸对发育性心脏缺陷的保护作用也在胎儿酒精谱系障碍的斑马鱼模型中有所描述,这证明了早期发育过程中持续接触酒精对心脏形态和生长的负面影响。斑马鱼也被用来模拟妊娠期糖尿病/高血糖对心脏发育的影响。总之,斑马鱼可以模拟遗传或环境起源的CHD的机制。
心肌病代表一系列心脏病,包括心肌的结构变化,包括三个主要类别。扩张型心肌病(DCM)是一种进行性疾病,其特征是心室扩大(通常为左心室)、心肌壁变薄和心输出量减少。肥厚型心肌病(HCM)与心室壁增厚有关。致心律失常性心肌病(ACM)涉及心肌细胞的变性,并逐渐被纤维脂肪瘢痕组织替代,影响心脏功能并导致结构性心脏重塑。通常,心脏功能逐渐受损,常常导致心力衰竭。心肌病和心力衰竭的标志在斑马鱼中是保守的,包括与心肌病和心力衰竭相关的基因的上调,例如nppa/nppb。因此,斑马鱼的研究通过对新型心肌病候选基因的功能验证,极大地促进了我们对心肌病潜在机制的理解(图 2)。例如,2015年的一项研究描述了胚胎和成年斑马鱼心脏的转录组学分析,确定51个DCM相关基因中49个的斑马鱼同源物。
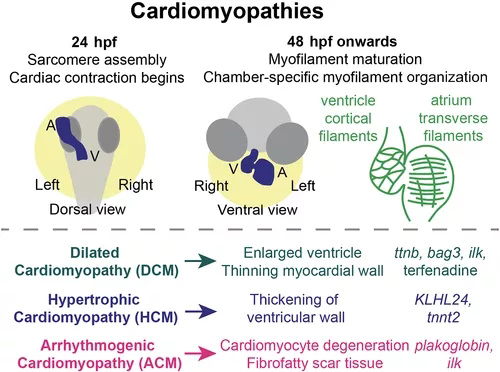
图2 心肌病模型。斑马鱼的心脏收缩力在 24 hpf 左右开始,此时心脏管已首次形成且肌节已组装。随着心脏发育,肌丝成熟,48 hpf 的心房和心室心肌细胞显示出不同的肌丝组织。心室壁心肌细胞显示皮质基底肌动蛋白,而心房心肌细胞形成跨越细胞的长肌丝,与血流方向垂直。肌节组装和功能的中断导致多种心肌病,以斑马鱼突变体或错误表达模型为代表,包括列出的那些。
TITIN(TTN)编码一个巨大的肌节蛋白,包含沿其长度的许多蛋白质的结合位点,这些蛋白与肌节的Z盘、I和A带以及M线区域相关联。TTN突变导致DCM和骨骼肌病,可能占DCM病例的25%。
然而,TTN基因内突变的位置似乎会影响疾病的严重程度,C末端的突变更可能与深度DCM相关。斑马鱼中CRISPR-Cas9介导的靶向突变揭示了为什么截断突变在斑马鱼中的位置TTN可能会影响疾病的严重程度。在后一项研究中,作者在斑马鱼ttnb基因(类似于人类TTN)中产生了六种不同的截断突变,导致z盘、近/中I带域或远端A带域中的截断。尽管所有突变都表现出降低的心脏功能,但具有C端截断的突变体也显示出骨骼肌肌节受损和瘫痪。
在ttnb的内含子中鉴定了一个额外的启动子,它产生一个短的ttnb仅编码蛋白质C端的转录物,其在骨骼肌中的表达水平高于心肌。因为这种较短的C端转录物仍然在N端截断全长ttnb的胚胎中表达,这可以解释为什么N端ttnb突变主要导致心脏缺陷,而影响两种转录物的C端突变导致在心脏和骨骼缺陷。这个内部启动子在小鼠中是保守的,而且,这个推定的启动子区域的位置位于导致人类TTN基因表型严重程度不同的等位基因之间的边界,提供了为什么遗传的位置的见解病变在TTN可能导致DCM的严重程度。
BLC2相关的athanogene 3(BAG3)编码与DCM相关的热休克蛋白共伴侣。起初,吗啉介导的斑马鱼bag3敲低是在 DCM 中识别BAG3 CNV后进行的,导致心包水肿和胚胎缩短部分减少,证实了心脏功能对Bag3的要求。然而,稳定的斑马鱼bag3突变体的产生表明,虽然对于胚胎心脏功能来说可有可无,但在成年期需要bag3。这以成人bag3为例斑马鱼突变体在6个月时表现出心脏功能下降和运动耐量降低,这与BAG3致病性变异患者的DCM发病年龄一致。
此外,从解剖的bag3突变斑马鱼心脏中分离出的单个肌原纤维的功能分析揭示了收缩力不足的缺陷,这是一种与DCM而不是HCM相关的表型,允许对bag3突变体中的心肌病进行分类,类似于患者所采用的。组合bag3/mTor斑马鱼突变体的比较分析表明,mTor信号传导的减少可以部分挽救在bag3突变体(Ding等,2019)。这表明mTor代表了bag3相关DCM的候选治疗靶点,并且bag3突变体可能代表了一种合适的模型来筛选新化合物以减轻与BAG3突变相关的DCM。
层粘连蛋白/整联蛋白/整联蛋白连接激酶(ILK)轴将细胞外基质连接到细胞骨架。斑马鱼的识别之流突变体,表现出DCM的标志,所提供的第一个证据中断到层粘连蛋白/整联蛋白信号可能导致心肌病。的靶向测序LAMA4和ILK的DCM队列随后揭示了一个错义突变ILK和10点的变体LAMA4其用DCM联,代表粘连的第一识别/整联用DCM相关的突变。
ILK中的杂合突变近来也与ACM相关。在这种情况下,表达野生型或疾病变体人ILK-GFP融合体的转基因斑马鱼的产生表明,这些ILK变体在3 dpf时导致部分缩短,而特定变体导致幼年阶段死亡。另一个斑马鱼ilk突变体等位基因,主挤压(msq),在ILK的激酶结构域中携带突变,尽管msq突变体中尚未描述DCM,但它们确实存在心脏收缩性缺陷。蛋白激酶B(PKB)磷酸化在msq突变体中下调。
然而,注射组成型活性PKB可以恢复心脏收缩力,表明PKB磷酸化是心脏发育所必需的。随后的一项研究利用了这一点,通过使用msq突变体作为筛选可以恢复收缩功能的化合物的工具,确定花萼A和冈田酸作为可以恢复msq突变体中心室部分缩短的药物,以及部分恢复PKB磷酸化。
执行靶向敲低、创建疾病特异性突变或过度表达疾病变异的能力使斑马鱼成为验证与DCM、HCM和ACM相关的新候选基因的宝贵模型。除了上述更好表征的基因或通路外,斑马鱼的功能研究还确定了多种基因在心肌病中的新作用,例如Raf1、Taf1a和Asn。斑马鱼DCM模型也已通过给予K+通道阻滞剂特非那定的药理诱导产生胚胎,而ACM的斑马鱼模型是使用心肌细胞驱动的斑珠蛋白疾病变异体的表达开发的,导致早期成鱼的心脏肥大和心房和心室壁变薄。通过将该ACM模型与nppa:荧光素酶转基因品系(在ACM斑马鱼心脏中上调)相结合,筛选了化学文库中可以改变ACM模型中nppa上调以及潜在拯救心脏功能的化合物。这种方法确定化合物SB216763,一种GSK-3抑制剂,可以使ACM模型中观察到的动作电位缺陷正常化,突出了斑马鱼模型对潜在治疗剂进行功能筛选的易处理性,这些治疗剂可以减轻DCM型表型。
传导障碍包括多种病理,其确切性质取决于整个心脏中电脉冲的产生或传播如何被破坏。尽管与哺乳动物相比,斑马鱼心脏的结构相对简单,但成年斑马鱼的心电图分析表明,成年斑马鱼心肌细胞的动作电位动力学与人类高度相似(图 3)。近来对斑马鱼心电图的改进包括温度考虑和麻醉方案的改进,很大限度地减少环境因素对动作电位分析的影响,优化探头定位和打开心包囊以提高信噪比。这些努力标准化测量并建立ECG参数的基线变化,可以更详细地分析衰老动物、心律失常遗传模型或副交感神经系统抑制时心律失常如何发展。可以通过超声心动图捕获和量化胚胎和成人的心脏收缩力,而心脏性能也通过使用游泳隧道的运动耐力间接测量,其中成年斑马鱼在流速增加的水流中进行定时游泳,并记录到疲惫的时间。
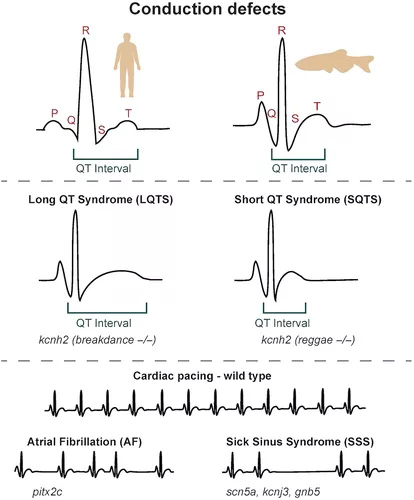
图3 心脏传导缺陷的斑马鱼模型。胚胎和成年斑马鱼心脏的心电图记录与从人类获得的心电图记录非常相似,具有可区分的 P 波、QRS 波群和 T 波,允许量化比较参数,如 QT 间期。长 QT 综合征和短 QT 综合征(LQTS 和 SQTS)均可由钾通道kcnh2中的突变引起,并分别由斑马鱼霹雳舞和雷鬼突变体建模。心脏起搏缺陷,如心房颤动(AF,失去规律的窦性心律)和病态窦房结综合征(SSS,有缺陷的窦性起搏,包括窦性暂停)也已使用斑马鱼功能丧失和错误表达模型进行建模。
除了斑马鱼和人类心肌细胞动作电位之间的相似性之外,斑马鱼心脏的传导动力学也对人类使用的通道阻滞剂和激活剂以及异丙肾上腺素和去甲肾上腺素等兴奋剂敏感。许多这类化合物对心脏功能或传导的影响类似于在人类中观察到的那些。施用刺激交感神经调节心脏功能的化合物,如去甲肾上腺素或异丙肾上腺素,会导致斑马鱼心动过速,而阿托品会抑制副交感神经输入,也会增加心率。
离子通道调节剂对斑马鱼的心脏传导有影响,类似于在人类中看到的那些。暴露于影响钾通道的化合物的胚胎的ECG分析揭示了对乙酰胆碱和卡巴胆碱,而给予E4031、白藜芦醇、特非那定、氟哌啶醇、苯海拉明和奥芬那君( hERG/KCNH2 K+通道阻滞剂)会延长动作电位持续时间(APD)和QT间期。
动作电位动力学分析表明,钠通道阻滞剂河豚毒素减少AP上行,而L型钙通道阻滞剂硝苯地平缩短平台期,塑造AP持续时间。硝苯地平和钙通道拮抗剂维拉帕米均诱导心动过缓,而BayK8644(L型钙通道激活剂)延长QT间期。在某些情况下,这些化合物还会以浓度依赖的方式诱发额外的心脏缺陷,包括心律失常和房室传导阻滞。在斑马鱼中也证明了抗心律失常药物的保守作用,胺碘酮和奎尼丁(这会导致心动过缓和延长 QT 间期)同样延长斑马鱼的QT间期。
然而,并非所有用于患者的化合物都会引起相同的反应。HMR1556(一种I KS阻滞剂)缩短而不是延长APD,而QT延长药物索他洛尔、红霉素、奎尼丁和阿米替林在斑马鱼中没有类似作用。这些差异可能是由于离子通道组成或功能的某些差异或化合物吸收不良造成的。这些药理化合物对心脏功能的影响可以揭示有关健康和疾病中心脏电生理学基础分子途径的信息。这通过额外的成像工具得到增强,例如由心肌启动子驱动的基因编码钙传感器,它能够对胚胎和幼鱼心脏中的瞬时钙动力学进行活体成像。光学电压映射还提供高分辨率的心脏电生理分析。这可以通过染料染色、基因编码电压传感器或近来开发的心肌线粒体ATP传感器。
长QT综合征(LQTS)、心房颤动(AF)和病态窦房结综合征(SSS)是在斑马鱼中建模的传导缺陷。LQTS的特征是延长的心肌复极时间,通过QT间期持续时间延长来诊断。由KCNH2编码的离子通道Kv11.1,中的突变是LQTS的原因,而斑马鱼breakdance突变体具有kcnh2突变,表现出在儿科LQTS中观察到的房室(AV)阻滞的断裂突变体被用作背景用于化学屏幕的化合物,其能抑制AV块。施用2-MMB或类固醇氟代肾上腺素内酯可缩短动作电位持续时间(APD)并挽救breakdance突变体中的AV阻滞,确定了两种可以缩短心肌复极化的潜在疗法。在将IKr钾通道阻滞剂特非那定应用于外植心脏后,膜片钳分析显示kcnh2突变体的AP持续时间同样增加,提供了进一步的功能证据,表明I Kr对斑马鱼心室的复极化至关重要。
尽管在突变的事实KCNH2与LQTS相关的杂合变异KCNH2与短QT综合征(SQTS)相关联。这种KCNH2变异在斑马鱼中的表达揭示了功能获得表型,解释了与传统的LQTS相关的KCNH2突变相比,该突变对QT间期的相反影响。斑马鱼Reggae突变体提供了进一步的证据,表明特定的KCNH2变体可能对QT间期产生相反的影响。Reggae突变体在kcnh2的电压感应域中存在损伤。
然而,与breakdance突变体不同,Reggae突变体表现出窦阻滞而不是AV阻滞。特非那定的给药降低了钾电流并挽救了Reggae突变体的表型,表明病变导致功能获得。支持这一点的是,Reggae突变体的动作电位持续时间显着减少,QT间期较短。因此,breakdance和Reggae突变体代表了LQTS和SQTS的斑马鱼模型,Reggae雷鬼代表第一个描述的SQTS动物模型的突变体(图3)。
AF的特征是不规则的心房起搏和经常增加的心率。斑马鱼中的增强子分析确定了假定的PITX2c调控序列,这些序列与人类中包含常见AF相关单核苷酸多态性 (SNP)的遗传区域重叠,表明PITX2的失调可能是AF的原因。成年pitx2c斑马鱼突变体的心电图分析显示心脏功能受损,伴有心房扩大和心房纤维化增加。这表明PITX2c变异可能是AF的一个致病因素。
病态窦房结综合征(SSS,也称为窦房结功能障碍),当窦房结(心脏的起搏器)无法产生规律的生理心率而导致心律失常时,就会出现病态窦房结综合征。GNB5是一种鸟嘌呤核苷酸结合蛋白亚基,参与向内向整流钾通道募集蛋白质,已在患有早发性窦房结功能障碍的个体中发现突变。碳酰胆碱和异丙肾上腺素对斑马鱼gnb5突变体的影响分析表明,GNB5是副交感神经控制心率所必需的,但不是交感神经控制所必需的。这表明GNB5的丢失将与静息时极度心动过缓有关——这一发现与GNB5突变患者的静息心率异常低一致(Lodder等,2016)。斑马鱼研究验证了在常染色体显性缓慢性心律失常家族中鉴定的KCNJ3变异的功能获得活性,并证明施用IKACh通道阻滞剂NIP-151可改善斑马鱼模型中的缓慢性心律失常表型。
功能测量、传导传感器和基因突变体都提供了合适的背景,可用作药理学筛选的基础,识别与心脏传导有关的新基因或改变传导动力学的化合物。进行了近300个插入突变体的筛选,以确定调节心脏传导的新基因和途径。将阳性结果与LQTS相关的全基因组关联研究(GWAS)数据进行交叉匹配,揭示了有丝分裂调节因子Gins3在动作电位动力学中的新作用。
在另一项研究中,筛选可恢复震颤突变体(钠钙交换剂Ncx1具有不稳定心脏收缩力的突变体)表明,用efsevin治疗可以恢复稳定的钙瞬变和细胞偶联,从而挽救心脏功能。
3.1 斑马鱼心脏再生模型
心肌梗塞(MI)后,人类无法补充丢失的心肌细胞会导致持续性瘢痕形成、心脏功能受损、心脏重塑,并导致心力衰竭。尽管成年小鼠心脏的再生潜力有限,但新生小鼠心脏能够产生再生反应。
然而,这种能力在产后7天就会丧失,对接受心室切除术的新生小鼠的长期随访表明长期瘢痕形成以及扩张型心肌病。
相反,斑马鱼能够在受伤后完全再生他们的心脏,为了解提高人类再生潜力的分子机制提供了一个宝贵的模型。斑马鱼的心脏再生模型对再生背后的时间过程以及支持这些反应的分子机制提供了重要的见解。损伤后3小时(hpi)的早期反应包括促炎分子的表达和免疫的募集细胞,这对疤痕沉积和随后的再生反应很重要。同时,未受伤组织中的心内膜细胞发生形态变化并重新表达发育基因。
在炎症和心内膜激活发生后,心内膜和心外膜是进行大规模再生的细胞层。在3到5dpi之间,损伤部位周围的心内膜细胞增殖,然后迁移到覆盖伤口区域的内表面。冠状动脉血运重建在损伤后迅速启动,血管网络需要促进再生。再生心脏的心电图分析表明,尽管再生过程中QT间期延长,但动作电位动态在再生后恢复正常。
已经建立了几种斑马鱼心脏损伤模型(图4),心室截肢捕获心脏进行再生的能力,形成纤维蛋白凝块,在30-60 dpi内逐渐被肌肉取代(Poss等,2002;Raya等,2003)。心肌梗塞在炎症和纤维化的同时诱导多种细胞类型的死亡。因此,再生不仅需要替换丢失的心肌细胞,还需要去除死细胞、基质重塑、血运重建和心脏机电耦合的重建(Frangogiannis,2006)。这可以通过冷冻损伤在斑马鱼中建模,冷冻损伤导致心室受损部分大量局部细胞死亡,导致所有心脏细胞类型的细胞凋亡,并复制MI后发生的心脏坏死(Gonzalez-Rosa等,2011)。诱导型基因消融模型,其中细胞类型特异性启动子驱动白喉毒素(DTA)或硝基还原酶(一种将甲硝唑转化为细胞毒性剂的酶)的表达,提供了对不同细胞类型如何促进心脏再生的进一步机制见解。
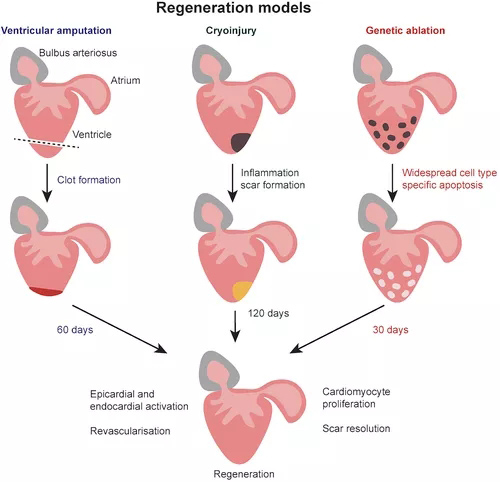
图4 斑马鱼再生模型。斑马鱼心脏在受伤后能够完全再生。在切除模型中,心室心尖被截断,导致形成纤维蛋白凝块,新的心脏组织在 60 天内生长。在冷冻损伤模型中,冷冻探针应用于心室,导致局部细胞死亡。随后发生炎症和细胞碎片清除,并在损伤部位形成疤痕。大约 120 天后疤痕消失,心脏再生。
有趣的是,尽管对冷冻损伤的再生反应很强,但疤痕吸收会随着反复损伤而减弱,并且在六次冷冻损伤后,心脏无法解决纤维化组织(Bise等,2020)。虽然这表明心脏可以在多次损伤后再生(多次损伤后心肌细胞本身的再生能力似乎不会受到影响),但它表明用新的心肌细胞替代纤维化组织的能力是有限的。多重损伤模型提供了将促再生程序与纤维化和疤痕消退的程序分开的机会,这可能对改善MI中的心脏功能有影响,尽管心脏存在疤痕。
斑马鱼遗传和再生模型的结合还可以深入了解心脏功能障碍如何改变再生能力,以及如何开发治疗剂以提高这种能力。斑马鱼霹雳舞突变体LQTS模型的心脏再生受损,与细胞外基质(ECM)沉积增加和过度炎症相关。尽管在该模型中施用炎性化合物如地塞米松或 MMP 抑制剂可促进疤痕消退和再生,但再生过程中免疫反应的时间和演变可能对介导再生至关重要。而斑马鱼代表了一个很好的模型,可以直接研究如何操纵免疫反应来促进人类的再生。
同样,靶向ECM重塑代表了一种有前途的治疗途径。2016年的一项研究表明,再生斑马鱼心脏的ECM在哺乳动物非再生模型中具有促进再生的作用,表明特定的ECM成分可能是促进再生特定方面的关键。与此一致的是,近来的研究报告称,将ECM组分集聚蛋白施用于MI后小鼠和猪心脏可改善心脏再生,证明斑马鱼的见解可以为制定治疗策略奠定基础。
虽然已经使用斑马鱼对心脏再生进行了重要的了解,但一个限制在于实时监测形态和功能恢复的能力,依赖于固定组织分析(尽管光片成像有助于在整个组织环境中可视化再生)。再生心脏MRI成像的进展为评估同一动物随时间的再生提供了新的机会(Koth等,2017),而开发用于培养外植受伤心脏的流体装置允许对血管重建等过程进行实时成像,提供对再生过程中特定细胞相互作用的更详细见解。
总体而言,对斑马鱼的心脏发育、功能和再生进行实时、体内分析的能力提供了一个独特的机会,来定义发育过程中的形态和功能异常与生命过程中的心脏功能障碍和结构重塑之间的关系。
文丨George Bowley, Elizabeth KuglerRob, Wilkinson4 | Allan Lawrie, Freek van Eeden, Tim J. A. Chico, Paul C. Evans, Emily S. Noël,Jovana Serbanovic-Canic
翻译丨郭盟
DOI丨 10.1111/bph.15473