
NEWS
新闻中心
SERVERS
服务项目
NEWS
最新资讯
发布时间:2024-07-26
2024年7月10日,国际顶尖学术期刊《Nature》刊发重磅成果!在题为《Tumor vasculature at single-cell resolution》的最新研究成果中,研究人员利用单细胞分辨率技术及斑马鱼技术,首次构建了大规模单细胞分辨率泛癌种脉管系统全息细胞图谱,为充分理解肿瘤血管生成的复杂过程提供了全景视角。
为更好地推动多组学与斑马鱼技术的广泛应用与纵深发展,助力科学研究,近日,环特生物与新格元深化战略合作,共同发布了“MS-ZTV平台解决方案”。
MS-ZTV(Multi-omics Sequencing -Zebrafish Target Validation)平台,即融合组学和斑马鱼基因编辑技术进行多维度基因功能验证研究,将聚焦多组学与斑马鱼基因编辑技术方案的联合应用,致力于提升学校及临床科研工作者科技能力与水平,也为揭示疾病机制、攻克遗传性疾病等提供强有力的技术支持。
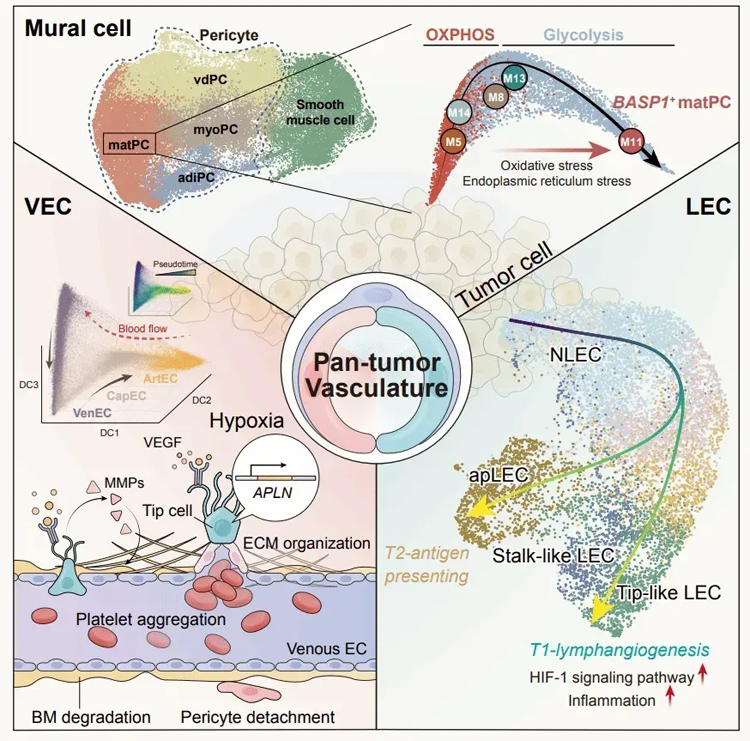
图为血管细胞、淋巴管细胞、壁细胞的演进特征和关键调控机制(引自Pan, X., Li, X., Dong, L. et al. Tumour vasculature at single-cell resolution. Nature (2024).
01——环特&新格元联合打造的“GS-ZTV”平台
近年来,单细胞测序、多组学与斑马鱼基因编辑技术等取得了令人瞩目的进展,并在众多生命科学研究项目中发挥了关键作用,为深入开展科学研究提供了强有力的工具。
GS-ZTV平台由新格元和环特生物联合打造,针对临床发现的新基因/新表型,基于多组学分析联合斑马鱼基因编辑技术,提供高效的组学—疾病表型验证整体解决方案,开展基因检测、基因功能验证服务等,可快速验证人类遗传病、筛选致病基因、研究基因功能及作用通路,并在10-40个工作日内完成基因功能验证、模型构建及多维度多指标的表型观察等,主要研究领域为婴幼儿发育畸形、罕见病、神经系统疾病、心脑血管疾病、血液病、生殖缺陷等。
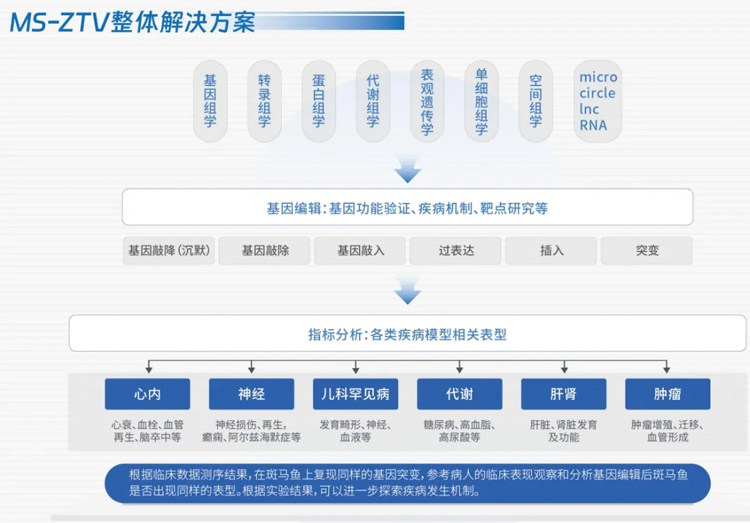
其中,MS(多组学)技术,基于基因组学、转录组学、蛋白组学、代谢组学、表观组学、单细胞组学、空间组学等多组学技术,构建基因调控网络,全面探索和深层次理解各生物分子之间的调控及因果关系,从而正确解析生命体的生物功能和生理机制。
而ZTV(斑马鱼基因功能验证),即利用多种基因编辑技术快速在斑马鱼模型中筛选和验证人类遗传病的致病基因、研究基因功能及作用通路、筛选和开发靶向药物等,可在10-40个工作日内完成基因功能验证、模型构建以及多维度多指标的表型观察。根据临床样本测序分析结果,在斑马鱼上快速复现同样的基因突变,参考病人的临床表现观察和分析基因编辑后斑马鱼是否出现同样的表型,并进一步探索疾病发生机制和靶向治疗方法。
单细胞多组学技术与斑马鱼基因编辑技术的联合应用,展现出全面多组学特色分析、直观及多维度观察、快速发现与验证、研究成功率高等诸多优势,通过一站式服务可以快速完成新基因的发现与功能验证,为前沿科学研究和疾病机制探索开辟了新方向。其优势表现为:
01、全面多组学特色分析
覆盖生物体内的多个层面,提供更完整的生物学信息;通过整合不同组学数据,深入理解生物过程的复杂性和动态性,有助于发现新的生物标志物、分子通路和疾病机制等。
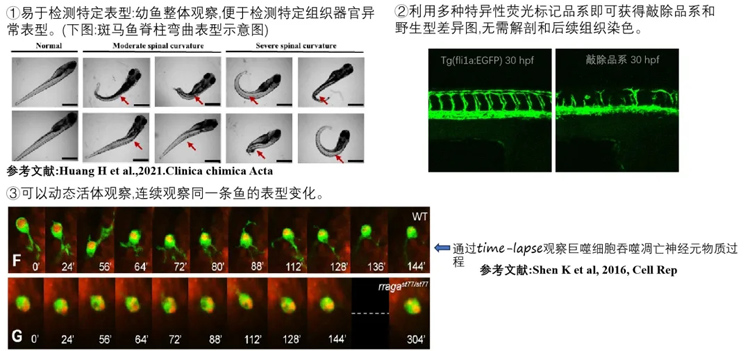
02、直观、多维度观察
相较于哺乳动物基因编辑表型不直观(一般需染色),斑马鱼基因编辑可对特定器官组织细胞进行荧光标记,利用透明斑马鱼活体观察和成像。
03、快速发现与验证
相较于哺乳动物基因编辑的试验周期长(一般1年以上),斑马鱼基因编辑功能研究最快可在2周内进行疾病相关的表型观察(F0代高效瞬时敲降),3个月内完成稳定品系构建。
04、研究成功率高
与哺乳动物相比较,斑马鱼基因编辑效率高,样本数量多,可同时测试多个相关基因,最大化保证研究的成功率。

02——GS-ZTV平台联合应用的研究进展
近年来,随着单细胞多组学技术与斑马鱼基因编辑技术的飞速发展与联合应用,不仅在遗传性疾病研究、药物研发、个性化医疗、基础科研等领域具有广阔的应用前景,而且有望激发更多科学研究创新与技术突破,为生命科学研究的进步注入新的动力。今天,我们一起来解读GS-ZTV平台联合应用案例——
01、用于肿瘤疾病研究
研究对象:多组学+斑马鱼联合分析,构建大规模泛癌种脉管系统全息细胞图谱
肿瘤的发生与进展和血管的生成息息相关。血管生成是肿瘤得以生存和扩散的关键。全面揭示肿瘤血管微环境特征、筛选为肿瘤细胞供能的关键内皮细胞,通过干预营养供给,能够为临床肿瘤患者的精准治疗提供有力依据。
2024年7月10日,重庆大学附属三峡医院作为第一完成单位和第一通讯作者单位联合清华大学、北京协和医院以及中南大学湘雅医院,在国际顶级学术期刊《Nature》(自然)发表最新研究成果——《Tumor vasculature at single-cell resolution》,该研究通过单细胞分辨率技术与斑马鱼技术,首次构建了大规模单细胞分辨率泛癌种脉管系统全息细胞图谱,该图谱涵盖来自372名捐赠者、31种不同癌症类型的约20万个细胞,为充分理解肿瘤血管生成的复杂过程提供了全景视角,不仅揭示了肿瘤血管的复杂性,更为开发新的抗癌血管生成疗法提供了潜在的临床意义。
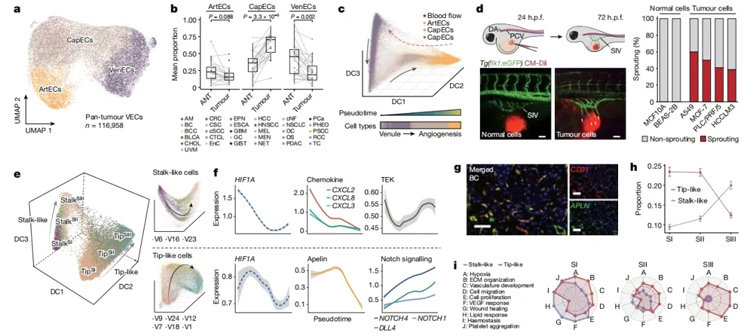
来源:Pan, X., Li, X., Dong, L. et al. Tumour vasculature at single-cell resolution. Nature (2024).
02、用于罕见遗传疾病研究
研究对象1:多组学+斑马鱼联合分析揭示人类关键遗传性视网膜疾病位点的基因调控机制
遗传性视网膜疾病(IRD)是一种导致视力障碍的疾病,研究表明,IRD中存在破坏活性CRE和/或3D基因组结构的遗传变异。
2024年5月17日,比利时根特大学生物分子医学系的Eva D’haene等研究人员在Genome Biology (IF: 12.3)上发表了最新研究成果《Comparative 3D genome analysis between neural retina and retinal pigment epithelium reveals differential cis-regulatory interactions at retinal disease loci.》。
该研究通过Hi-C和H3K4me3 HiChIP在成人眼睛的神经视网膜和RPE/脉络膜上绘制了全基因组染色质相互作用图。在神经视网膜和RPE/脉络膜中分别观察到活性启动子与32425和8060个候选CRE之间的染色质环。对这两种组织进行的3D基因组比较分析显示,在290个已知的遗传性视网膜疾病基因中,56%的基因具有不同的染色质相互作用。其中之一是ABCA4,它与最常见的常染色体隐性遗传性视网膜疾病有关。使用高分辨率UMI-4C放大了ABCA4基因座上视网膜和RPE特异性顺式调节相互作用。最后,通过挖掘单细胞数据和斑马鱼体内增强子测定实验揭示了组织特异性CRE与ABCA4的相互作用。
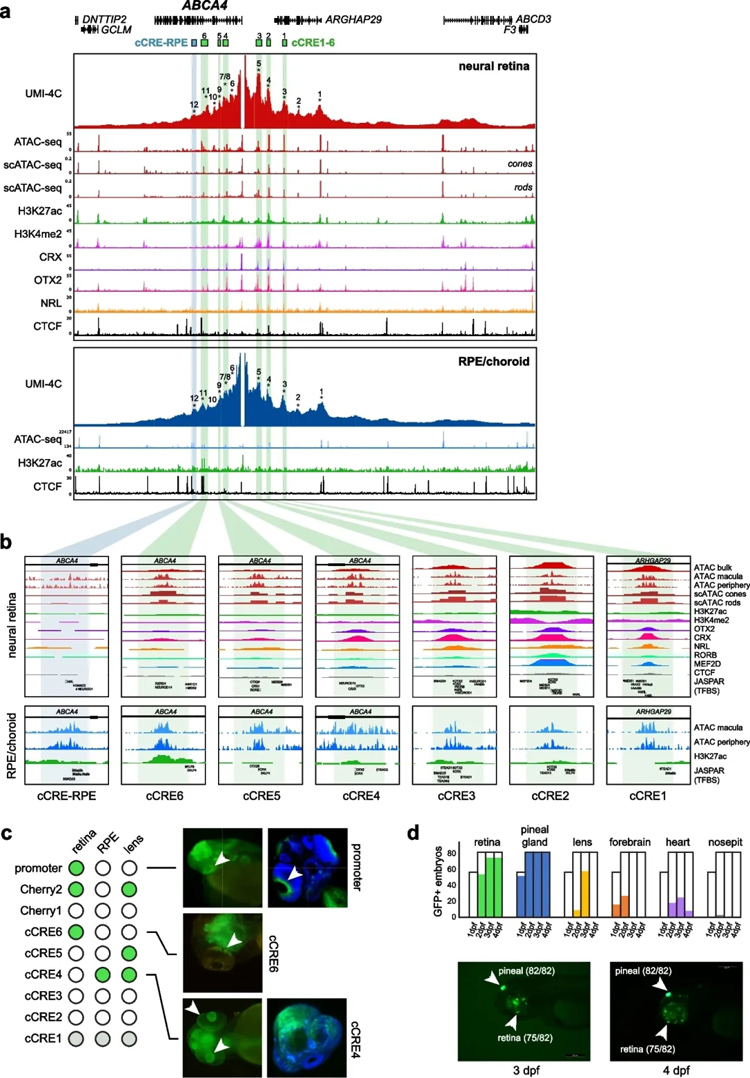
来源:Eva D’haene, et al. Comparative 3D genome analysis between neural retina and retinal pigment epithelium reveals differential cis-regulatory interactions at retinal disease loci.Genome Biology(2024)
研究对象2:人类视网膜的多组学+斑马鱼联合分析揭示了罕见眼病位点的超保守顺式调节元件
跨物种基因组比较揭示了大量的超保守非编码元件,其中一些元件已被证明是发育基因表达的重要组织和细胞类型特异性顺式调节因子。将一组UCNE描述为视网膜发育过程中的候选CRE(cCRE),并评估其基因组变异对罕见眼病的贡献。
2024年2月21日,Nature Communications(IF=16.6)上发表了最新研究成果《Multi-omics analysis in human retina uncoversultraconserved cis-regulatory elements at rare eyedisease loci》,该研究通过多组学+斑马鱼技术联合分析,鉴定出 1487个在人类视网膜中具有候选顺式调节作用的UCNE,并改进了人类视网膜中UCNE的功能注释,这些UCNE代表了未被充分研究的非编码变异靶标,可以解释罕见眼病中遗传力缺失的原因。
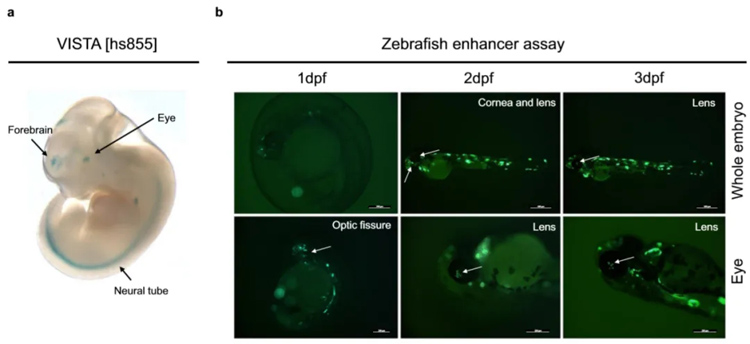
来源:Victor Lopez Soriano, et al. Multi-omics analysis in human retina uncoversultraconserved cis-regulatory elements at rare eyedisease loci.Nature Communications(2024)
03、用于表观遗传学调控机制研究
研究对象:多组学+斑马鱼联合分析为造血干/祖细胞(HSPC)命运决定的表观遗传调控机制提供新的见解
2024年06月18日,华南理工大学医学院研究团队在Stem Cell Research & Therapy上发表了最新研究成果《Reprogramming of 3D genome structure underlying HSPC development in zebrafish》,该研究通过多组学+斑马鱼技术联合分析,为脊椎动物HSPC命运决定的表观遗传调控机制提供新的见解。
研究人员通过sisHi-C、H3K27ac ChIP-seq、H3K4me3 ChIP-seq、ATAC-seq和RNA-seq在内的多组学分析,全面剖析斑马鱼HSPC的3D基因组重排及其与转录变化和细胞功能的关系,发现斑马鱼HSPC的染色质组织与哺乳动物细胞相似,具有类似的层次结构,并揭示了HSPC发育过程中染色质结构的多尺度重组及其对转录调控和细胞命运转换的影响。新生HSPC的特点是构象松散,各层结构不明显。此外,PU.1被鉴定为介导启动子参与环的形成和调控HSPC基因表达的潜在转录因子。
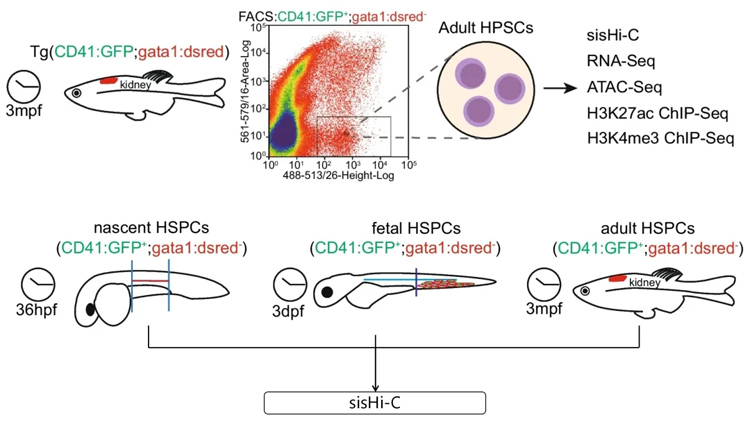
来源:Min He, Xiaoli Li, et al. Reprogramming of 3D genome structure underlying HSPC development in zebrafish.Stem Cell Research & Therapy(2024).dol.org/10.1186/s13287-024-03798-x
04、用于药物筛选评价
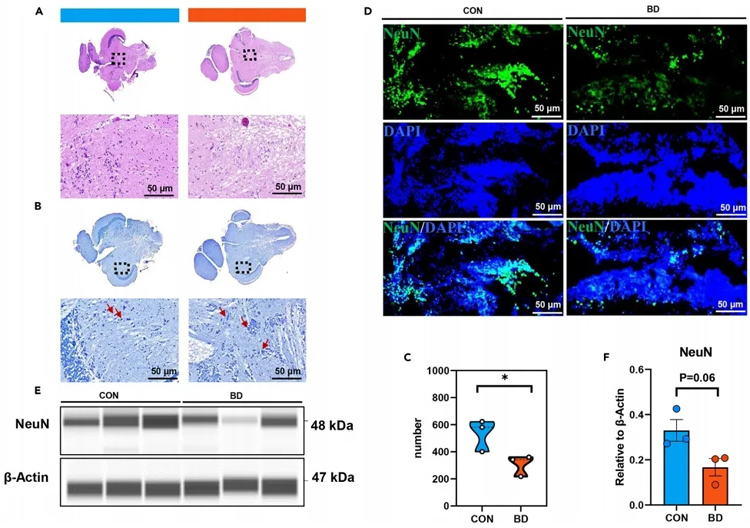
研究对象:多组学+斑马鱼联合分析发现氟喹诺酮类抗生素药物环丙沙星可诱导斑马鱼发生双相情感障碍行为(BD)
双相情感障碍(bipolar disorder,BD)作为一种常见精神障碍,炎症反应在BD发病机制中起着至关重要的作用,但其潜在机制尚不清楚。
鉴于BD发病机制的复杂性,环特合作伙伴——中国农业科学院质标所的“农产品质量安全风险评估”创新研究团队于2023年5月19日发表在Cell Press《iScience》上的题为“Multi-omics analysis of a drug-induced model of bipolar disorder in zebrafish”的最新研究成果,该研究通过对BD斑马鱼进行高通量、多组学分析(代谢组学、脂质组学和转录组学),揭示了其分子作用机制,构建了一种新的BD斑马鱼模型,并发现氟喹诺酮类抗生素药物环丙沙星可诱导斑马鱼发生双相情感障碍行为(BD)。这是首次利用斑马鱼模型来揭示双相情感障碍模型中潜在相关病理学机制,也是首次引入药物诱导的双相障碍斑马鱼模型研究。
详情请点击:论文解读 | 中国农科院质标所基于斑马鱼双相情感障碍模型,开展多组学分析研究
05、用于神经等各类毒性研究
研究对象:多组学+斑马鱼联合分析,揭示锰暴露影响斑马鱼大脑的铁死亡途径
2023年2月,首都医科大学牛丕业教授团队在Ecotoxicology and Environmental Safety杂志(IF:7.129)发表了题为《Multi-omics analysis reveals Mn exposure affects ferroptosis pathway in zebrafish brain》的研究成果,该研究采用单细胞转录组测序技术找到神经元的关键类型,同时整合了代谢组学,揭示铁死亡是锰诱导神经毒性的一种新的潜在机制。
该研究通过多组学分析,发现过度暴露于Mn会破坏神经元的转录和代谢过程。同时,对于Mn暴露,DA神经元最先出现反应。本研究结果首次深入了解铁死亡在Mn神经毒性中的潜在机制。
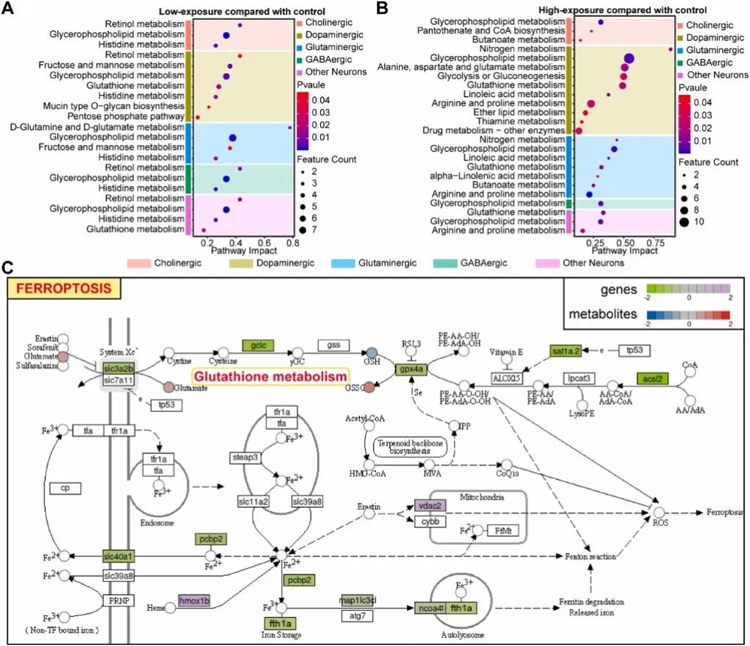
来源:Shixuan Zhang , et al. Multi-omics analysis reveals Mn exposure affects ferroptosis pathway inzebrafish brain.Ecotoxicology and Environmental Safety(2023)
展望未来,环特生物与新格元将依托于GS-ZTV平台,通过斑马鱼基因编辑技术与多组学技术联合应用,为科研工作者提供高效的组学—疾病表型验证整体解决方案,开展多维度基因功能验证研究,更深度激发科学研究的创新潜力,为未来生命科学领域的发展注入了新的活力!
业务合作咨询:成先生 173 6453 1293(微信同号)

上一篇:小分子也有大世界