
NEWS
新闻中心
SERVERS
服务项目
NEWS
最新资讯
发布时间:2024-07-22
参考文献
题目:col1a2+ fibroblasts/muscle progenitors finetune xanthophore countershading by differentially expressing csf1a/1b in embryonic zebrafish
作者:陈嘉豪、王洪高、吴淑婷等
期刊:Science Advances
01、什么是基因编辑?
基因编辑是指通过基因编辑技术对生物体基因组特定目标进行修饰的过程。高效而精准的实现基因插入、缺失或替换,从而改变其遗传信息和表现型特征。
CRISPR基因编辑技术诞生于2012年,它被誉为“21世纪以来生命科学领域最受关注的科学突破之一”。2020年,CRISPR基因编辑技术获得诺贝尔奖的认可,而在2023年12月,美国FDA批准了首款基于CRISPR的基因编辑疗法上市,用于治疗镰状细胞病(SCD)。这意味着CRISPR可以真正意义上解决患者面临的挑战性问题。
作为分子生物学领域最重大的进展之一。随着2023年底首次批准基于CRISPR疗法用于人类疾病治疗,CRISPR基因编辑正在进入一个新时代。
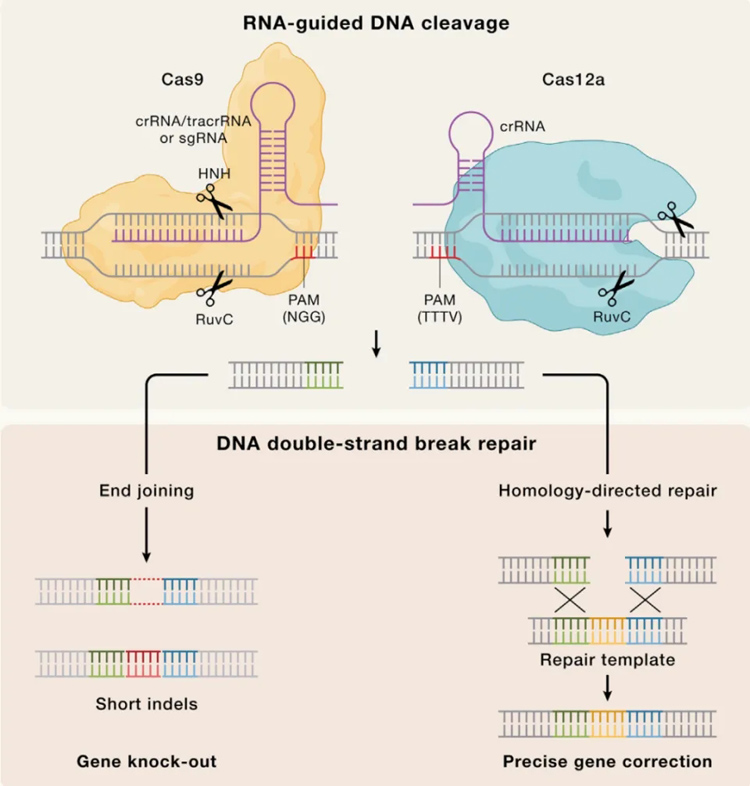
图:CRISPR基因组编辑的分子原理
CRISPR-Cas核酸酶的可编程性使其能够产生位点特异性的DNA双链断裂,从而使其能够快速适应基因组编辑技术。来自化脓链球菌的典型Cas9蛋白(SpCas9)是第一个被用于基因组编辑的Cas核酸酶,由于其固有的高活性和特异性,目前仍然是最广泛使用的基因编辑器。CRISPR-Cas系统作为简单有效的可编程基因编辑工具的重新应用,极大地推进了许多基础和应用研究领域,为开发靶向基因治疗和各种生物技术应用奠定了基础。
02、反影伪装
物竞天择,适者生存。在危机四伏的大自然中,生物为了适应复杂多变的生存环境从而进化出丰富的体表特征和形态各异的色素图案。这些看似只是随机组合的颜色排列模式所代表的生物学功能绝非美观这么简单:物种识别、生物伪装、繁衍生息乃至在极端环境下的耐受等等,色素图案的功能不胜枚举。在这其中,反影伪装是脊椎动物中分布最为广泛的色素图案之一。
反影伪装是一种常见于动物身上的颜色,其典型的特征是动物的背部(背侧)是深色的,而下侧(腹侧)是浅色的,这种明暗处理有助于动物融入周围环境。在哺乳动物中,反影伪装的形成主要依赖于ASIP-MCR1信号通路对于黑色素生成的调控。与哺乳动物类似,成年斑马鱼的反影伪装也同样依赖于Asip-Mcr1信号通路对于色素细胞的调控。目前ASIP-MCR1通路是唯一已知的调控脊椎动物反影伪装的信号通路。然而是否存在新的调控通路尚不明确。
发表在Science Advances杂志上的一篇题为“col1a2+ fibroblasts/muscle progenitors finetune xanthophore countershading by differentially expressing csf1a/1b in embryonic zebrafish”的论文通过研究发现了Csf1r影响斑马鱼色素图案形成过程的新功能,揭示了Csf1-Csf1r信号是调控斑马鱼幼鱼黄色素细胞形成反影伪装的信号通路。
03、斑马鱼反影伪装发生的分子机制
研究者在白光下观察发现,之前被普遍认为是散在分布的斑马鱼幼鱼黄色素细胞,呈现背侧多腹侧少的反影伪装排列方式,利用黄色素细胞的自发荧光观察后确认了这一现象。

图:斑马鱼幼鱼皮肤黄色素细胞的分布
研究者接下来使用黄色素细胞的标记基因gch2对反影伪装的形成过程进行了探究,结果显示,黄色素细胞从胚胎受精后24小时(24 hpf)开始从背侧往腹侧迁移,至30 hpf黄色素细胞背侧多而腹侧少的反影伪装图案形成。
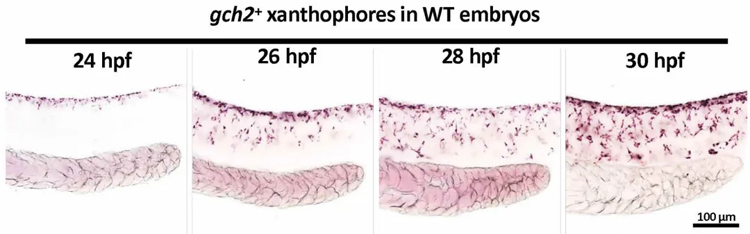
图:斑马鱼发育过程中黄色素细胞从背侧向腹侧迁移
通过进一步研究显示,Csf1r的天然配体Csf1a和Csf1b具有不同的表达模式,csf1a在整体躯干广泛表达,而csf1b只局限表达在背侧躯干,这两个因子差异性地影响了黄色素细胞反影伪装的形成,csf1a突变体的腹侧缺失黄色素细胞,而csf1b突变体的背侧黄色素细胞数量在减少。
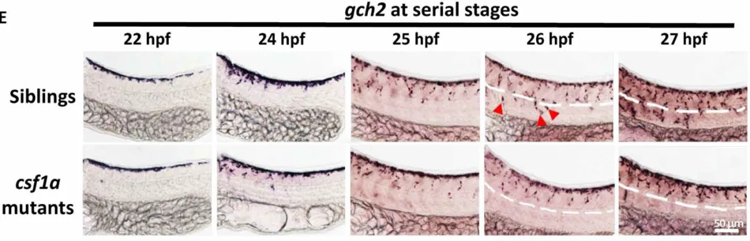
在中枢神经系统异位表达Csf1a和Csf1b后,发现黄色素细胞会往中枢神经系统位置迁移,而这一迁移行为在Csf1r突变体中消失,提示Csf1配体通过Csf1r受体对黄色素细胞起趋化作用。
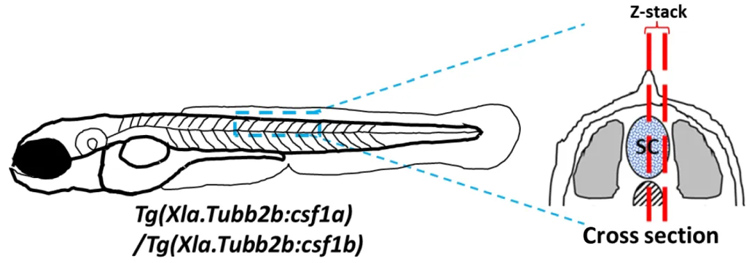
图:斑马鱼中异位表达csf1a/csf1b的方法
通过单细胞RNA测序,研究者发现csf1a和csf1b表达富集的细胞群与Col1a2+成纤维细胞和肌肉前体细胞高度重合,且不同的成纤维细胞和肌肉前体细胞亚群差异性地表达csf1a和csf1b。
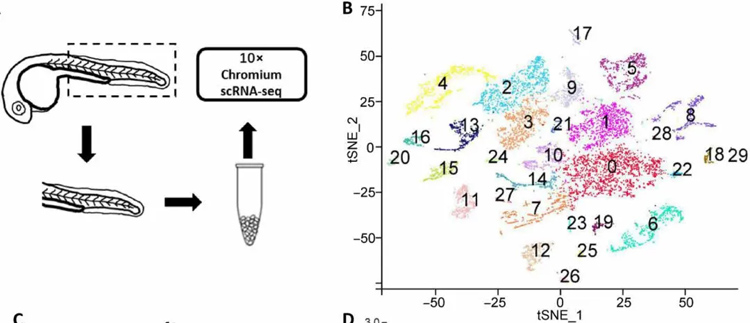
图:单细胞测序分析细胞类型
最后,对Col1a2+细胞进行去除后,csf1a和csf1b的表达量降低,进而导致黄色素细胞反影伪装被破坏。
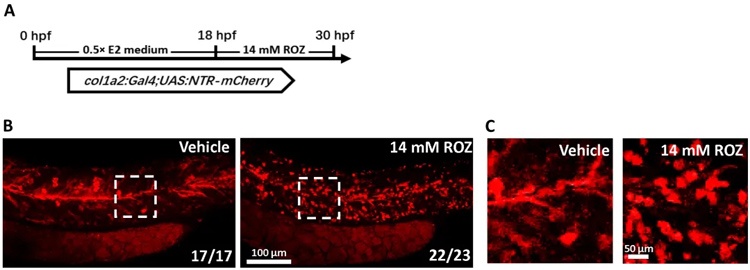
图:斑马鱼中去除col1a2+细胞的方法
这一前沿研究证实了斑马鱼躯干不同亚群的Col1a2+成纤维细胞和肌肉前体细胞通过差异性表达csf1a和csf1b,经由Csf1r介导的趋化吸引作用,最终引导斑马鱼幼鱼黄色素细胞反影伪装的形成,具有非常重要的生物学意义,也为研究脊椎动物色素模式的形成机制提供了极具价值的参考。
现如今,环特生物依托国际领先的斑马鱼基因编辑技术,构建了包含斑马鱼基因敲降(沉默)、敲除、敲入、转基因、过表达、点突变等全方位且专业化的基因编辑技术服务,更将流程化、体系化、模块化的技术优势贯彻始终,为基因编辑技术的现实应用提供定制化解决方案。
技术咨询请联系:17364531293(微信同号)