
NEWS
新闻中心
SERVERS
服务项目
NEWS
最新资讯
发布时间:2023-06-29

核心观点
自180多年前细胞分裂首次被描述以来,只有有丝分裂和减数分裂得到了充分研究。环特生物专家工作站专家、台湾中原大学萧崇德教授与台湾中央研究院细胞与个体生物学研究所陈振辉团队,创建了一套多色细胞膜标记系统palmskin,对斑马鱼发育过程中整个浅表上皮细胞(SECs)进行全程监测,从而突破性发现了一种新型的、无需DNA扩增的细胞分裂形式——斑马鱼浅表上皮细胞的“非合成裂变”!该研究成果于2022年5月5日以“Skin cells undergo asynthetic fission to expand body surfaces in zebrafish”为题在线发表于Nature。
研究人员发现,斑马鱼发育过程中进行分裂的基本上均为浅表上皮细胞。在特定发育窗口期,单个浅表上皮细胞最多能形成4个子代细胞。即使没有发生DNA复制,这些浅表上皮细胞也会持续分裂。研究人员将斑马鱼发育过程中实时发生的分裂方式定义为“非合成裂变”(asynthetic fission)。
一、研究背景:
在生长发育过程中,动物的表皮细胞会快速增殖以覆盖新长出的身体。脊椎动物皮肤呈多层结构,在小鼠和斑马鱼模型中进行的经典命运图谱研究确定了“表皮基底层内的某些上皮细胞能够产生基底上皮细胞(basal epithelial cells,BECs)、基底膜上层上皮细胞(suprabasal epithelial cells)和浅表上皮细胞(superficial epithelial cells,SECs)”。
然而,小鼠和斑马鱼表皮间的一个重要解剖学差异是——斑马鱼没有角质化、无核的细胞层,其最外层为高度分化的上皮细胞(SECs)和一层薄薄的透明黏液,类似于哺乳动物中典型的非角化层状上皮。因此,这些通体透明的斑马鱼胚胎,非常利于借助高分辨率光学显微镜进行周身观测,为实时动态研究动物表皮如何扩张增殖提供了绝佳条件。
为了实时动态研究斑马鱼表皮上皮细胞的形态和尺寸变化,研究人员通过细胞膜标记技术展示了细胞间的边界,并构建了上皮细胞的多色展示系统。这一系统可以显示横跨红、绿、蓝的60余种色调,清晰显示微桥这一浅表上皮细胞特有结构,记录、分析斑马鱼细胞形状、细胞谱系等,从而研究它们在机体发育过程中的动态变化。
二、研究成果:
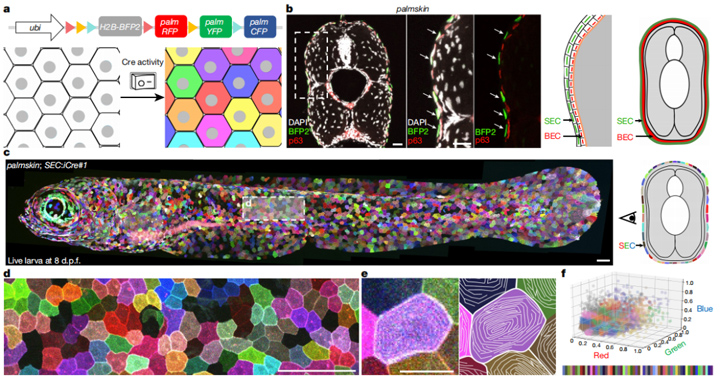
图1:斑马鱼表皮中上皮细胞SEC多色条形码
1. SEC的大量细胞分裂增殖
研究人员结合多颜色活细胞标记策略,通过全细胞成像实验表明,斑马鱼幼鱼无论是长度还是体表面积均飞速增长,24小时分别增长10%和22%。值得一提的是,浅表上皮细胞数量迅速增长了21%。而且,因为新增细胞通常与周边细胞颜色相同,说明这些细胞基本上是单细胞克隆而来。此外,10天后,斑马鱼头部上皮细胞增殖快于尾部。
值得注意的是,尽管斑马鱼表面积和浅表上皮细胞SEC数量明显增加,但单个细胞的顶面面积平均下降了6%。
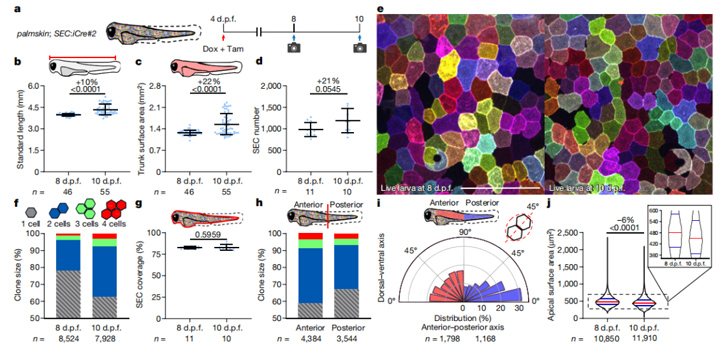
图2:全细胞成像显示SEC中的大量细胞分裂
2. 单个浅表上皮细胞产生4个子代细胞
为了研究斑马鱼上皮细胞的分裂过程,研究人员通过实时成像技术每15分钟拍摄一次(图3a)。研究人员发现,许多浅表上皮细胞在体表分裂,没有基底上皮细胞和基底膜上层细胞的分裂(图3b)。分裂沿着长细胞轴发生偏移,并且分裂后的细胞更圆(图3d-f),这表明存在应力松弛现象。
另外,研究人员发现,单个浅表上皮细胞SEC最多可以分裂两次,产生4个子代细胞(图3h)。大多数SECs在脱落前分裂(90%)(图3j),并且这些细胞偶尔会发生融合。
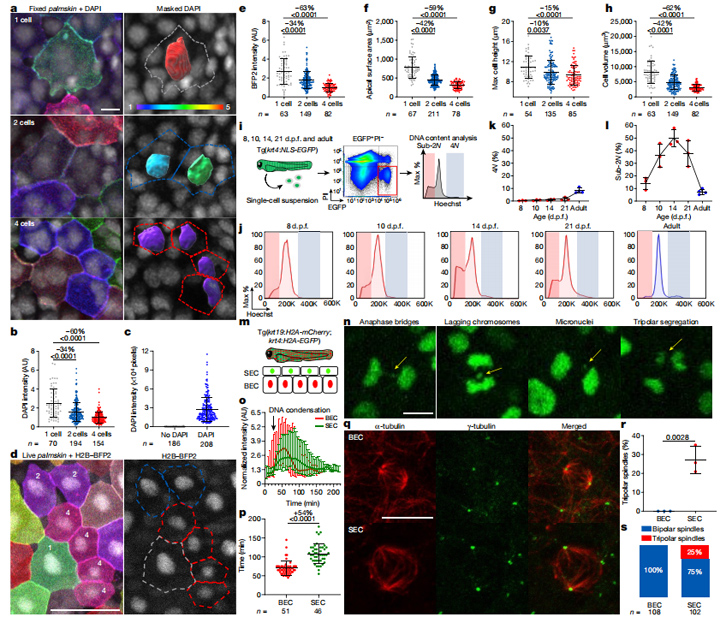
图3:SEC分裂产生的子代细胞基因组减少,非合成分裂容易发生错误
3. 浅表上皮细胞的非合成分裂
为了研究斑马鱼幼鱼的具体分裂模式,确定其SEC没有DNA复制,研究人员利用有染料的EdU(一种胸腺嘧啶核苷类似物,可参与DNA复制)培养斑马鱼浅表上皮细胞。通过EdU染色发现,在6、8、10和14天中,检测到大量的基底上皮细胞1.3~4.7%呈EdU阳性,也就是发生DNA复制;而没有检测到任何浅表上皮细胞呈EdU阳性。
为了确定浅表上皮细胞是否能在DNA复制抑制剂羟基脲(HU)阻断的情况下分裂增殖,研究人员在成像前对斑马鱼进行HU处理。结果表明,尽管HU处理几乎消除了所有EdU阳性的基底上皮细胞BECs(97%,图5e-g),但HU处理完全不能以类似程度阻断浅表上皮细胞增殖,仍观察到显著增加87%的细胞(图5h-k)。
因此,浅表上皮细胞可以通过一种独特的细胞分裂方式在体内增殖,使表皮细胞数量增加4倍,而没有明显的DNA复制迹象。如果体细胞增殖而DNA没有进行复制,那么就会出现子代细胞基因组减半的情况。值得注意的是,通过DAPI染色发现浅表上皮细胞的子代和孙代基因组分别减少34%和60%,组蛋白水平和细胞大小也降低。
总之,研究人员得出结论,浅表上皮细胞分裂是一个独特的动态事件,最常发生在斑马鱼发育过程中。基于EdU分析、DAPI染色、组蛋白滴定、HU处理和基于流式细胞术的DNA含量分析,研究人员将这种在斑马鱼发育过程中实时发生的分裂方式定义为非合成裂变(asynthetic fission),因为这个过程不需要DNA复制来产生更多的细胞。
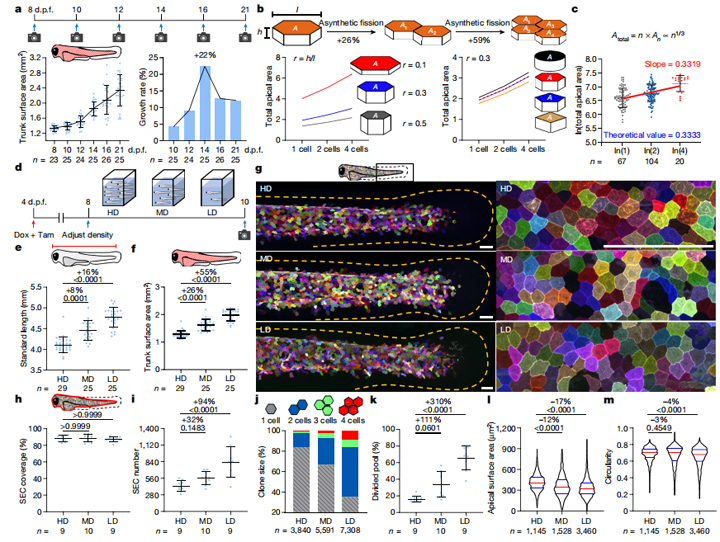
图4:体细胞的动态需求决定了非合成裂变
4. 非合成裂变增加表皮顶端表面积
基因组异常的体细胞通常会凋亡或具有特别的生理学功能,研究人员据此推测非合成裂变的斑马鱼浅表上皮细胞是否具有特别的功能。实验发现,斑马鱼出生后14天,表皮扩增速率达到峰值,这与非合成裂变峰值时间吻合。
与此同时,研究人员进一步实验结果表明,非合成裂变可能是一类节省资源的机制,可以在斑马鱼快速生长时期,用尽可能短的时间产生上皮细胞从而覆盖更大的表面积。
5. 体表面生长影响非合成裂变
如果非合成裂变是在快速生长过程中增加上皮细胞覆盖范围的一种强大机制,那么,它应该具有普适性。通过调整饲养密度,研究人员将斑马鱼置于不同密度环境之中(高密度每2ml水一只鱼,中密度每20ml,低密度每200ml),以便在2天内将斑马鱼体长和表面积扩大到3种不同水平(图4d-f)。实验发现,斑马鱼密度越低,浅表上皮细胞增殖水平越高。
随后,研究人员推测,在斑马鱼生长过程中,表皮张力的动态变化可能介导了SEC的分裂。通过检查再生鱼鳍组织中SEC分裂,研究结果显示,随着斑马鱼幼鱼的生长,在未检测到细胞复制其基因组的情况下,斑马鱼细胞受牵张力引导发生了分裂。这种“无合成分裂”所产生的子细胞比它们的母细胞更平、更小,DNA等生物材料也比母细胞要少,但它们总的表面积更大,仍能保障上皮细胞覆盖快速生长的斑马鱼表面。
SEC中的非合成裂变提供了灵活性和适应性,体表面生长的整体或局部操纵会影响SEC分裂的程度和模式,这可能是通过张力介导的拉伸激活离子通道来实现的。研究人员也进一步推测,这种简单而灵活的细胞增殖模式,也可能发生在斑马鱼皮肤扩张以外的情境中。
三、结论:
综上所述,研究人员通过多色细胞膜标记系统实时检测斑马鱼幼鱼的浅表上皮细胞分裂情况。实验结果表明,在斑马鱼生长过程中,最多只能分裂两次,产生四个子代细胞,并且,分裂时无需DNA扩增。
参考文献
[1] Tai, K., Cockburn, K. & Greco, V. Flexibility sustains epithelial tissue homeostasis. Curr.Opin. Cell Biol.60, 84–91 (2019).
[2] Dekoninck, S. et al. Defining the design principles of skin epidermis postnatal growth.Cell 181, 604–620 (2020).
[3] Gonzales, K. A. U. & Fuchs, E. Skin and its regenerative powers: an alliance between stemcells and their niche.Dev. Cell 43, 387–401 (2017).
[4] Lee, R. T., Asharani, P. V. & Carney, T. J. Basal keratinocytes contribute to all strata of theadult zebrafish epidermis. PLoS ONE 9, e84858 (2014).
[5] 5.Rakers, S. et al. Antimicrobial peptides (AMPs) from fish epidermis: perspectives for investigative dermatology. J. Invest. Dermatol. 133, 1140–1149 (2013).
[6] Jones, K. B. et al. Quantitative clonal analysis and single-cell transcriptomics reveal division kinetics, hierarchy, and fate of oral epithelial progenitor cells. Cell Stem Cell 24,183–192 (2019).
[7] .Jones, K. B. & Klein, O. D. Oral epithelial stem cells in tissue maintenance and disease: the first steps in a long journey. Int. J. Oral Sci. 5, 121–129 (2013).
[8] Chen, C. H. et al. Multicolor cell barcoding technology for long-term surveillance of epithelial regeneration in zebrafish. Dev. Cell 36, 668–680 (2016).
[9] Livet, J. et al. Transgenic strategies for combinatorial expression of fluorescent proteins in the nervous system. Nature 450, 56–62 (2007).
[10] Loulier, K. et al. Multiplex cell and lineage tracking with combinatorial labels. Neuron 81,505–520 (2014).
[11] Lam, P. Y., Mangos, S., Green, J. M., Reiser, J. & Huttenlocher, A. In vivo imaging and characterization of actin microridges. PLoS ONE 10, e0115639 (2015).
[12] van Loon, A. P., Erofeev, I. S., Maryshev, I. V., Goryachev, A. B. & Sagasti, A. Cortical contraction drives the 3D patterning of epithelial cell surfaces. J. Cell Biol. 219,e201904144 (2020).
[13] Guzman, A., Ramos-Balderas, J. L., Carrillo-Rosas, S. & Maldonado, E. A stem cell proliferation burst forms new layers of p63 expressing suprabasal cells during zebrafish postembryonic epidermal development. Biol. Open 2, 1179–1186 (2013).
[14] Slanchev, K. et al. The epithelial cell adhesion molecule EpCAM is required for epithelial morphogenesis and integrity during zebrafish epiboly and skin development. PLoS Genet. 5, e1000563 (2009).
[15] Richardson, R. J. et al. Periderm prevents pathological epithelial adhesions during embryogenesis. J. Clin. Invest. 124, 3891–3900 (2014).
[16] Wyatt, T. P. et al. Emergence of homeostatic epithelial packing and stress dissipation through divisions oriented along the long cell axis. Proc. Natl Acad. Sci. USA 112,5726–5731 (2015).
[17] Chen, C. F. et al. Establishment of a transgenic zebrafish line for superficial skin ablation and functional validation of apoptosis modulators in vivo. PLoS ONE 6, e20654 (2011).