
NEWS
新闻中心
SERVERS
服务项目
NEWS
最新资讯
发布时间:2023-06-14

编者按:肺癌类器官(LCO)可重现亲代肿瘤的组织学和遗传特征。利用集成超疏水性微孔阵列芯片(InSNAR-chip),数百个LCO最少能够在一周内产生临床意义的药物应答。
今天,我们回顾了一项于2021年5月10日发表在《自然·通讯》的经典研究——《Lung cancer organoids analyzed on microwell arrays predict drug responses of patients within a week》,该研究为预测临床上患者的特定药物应答情况提供了一种技术上可行的方法。
一、研究背景
尽管药物的可获得性越来越高,但由于缺乏对治疗结果的准确预测,无法及时为患者选择合适的治疗方案,肺癌仍是全球癌症死亡的主要原因[1],虽然DNA 测序开创了精准医疗的时代,但肿瘤的异质性可能会混淆这种基因-药物联系[2]。因此体外肿瘤模型在基因组学和病理学结果之间发挥着重要作用。患者衍生的异种移植物(PDX)常常被用于预测患者的药物应答反应,但由于成功率低、周期时间长、成本高、成功率有限[3]。
后来,患者衍生的肿瘤类器官(PDO)成为精准医学中一种可靠的体外肿瘤模型[4][5][6]。然而目前基于PDO的药物测试仍然需要数月才能向患者提供结果,主要原因是使用传统的细胞培养技术,需要长时间的体外扩增才能产生足够数量的PDO[7],而且目前还有某些类型的肿瘤尚未建立PDO的培养条件。
为了克服上述技术挑战,本研究设想通过使用微加工阵列设备(通常用纳升体积即可),来减少基于PDO的药物测试反应体积。首先从患者样本中获取大量肺癌类器官(LCO),验证其肿瘤器官形态、组织病理学、DNA CNV突变谱和基因表达与原始肿瘤一致,再开发一种集成的超疏水微孔阵列芯片(InSMAR-chip),用于高通量三维(3D)培养和分析[8][9]。LCO结合InSMAR芯片可为及时预测肺癌患者的特异性药物反应提供一种有效的方法。
二、研究结果
1. 肺癌组织来源的LCO的构建
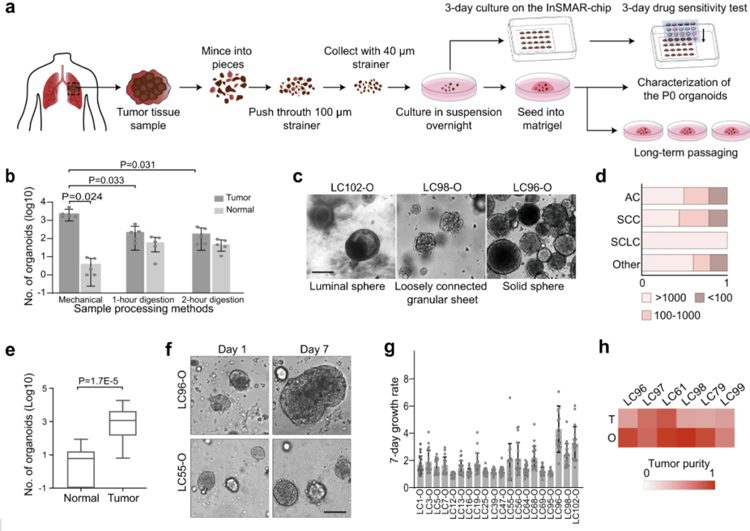
原文图1 构建LCO的过程图
本研究使用机械法处理了103例手术切除的肺肿瘤样本,包括71例腺癌(ACs),23例鳞状细胞癌(SCCr),4例小细胞肺癌(SCLCs)和5例其他亚型的肺癌。利用InSNAR芯片对一种药物进行敏感性测试,对于类器官数量的最小需要量约为100个,而在本研究中,71例AC中有55例,23例SCC中有18例、4例SCLC中有4例和5例其他肺癌样本中的4例构建后获得了大于100个类器官,因此本研究中的样本处理成功率为79%。在这103例样本中,有42例肿瘤和相应的正常组织一起处理,每例正常组织大约只产生了15个 正常肺类器官(NLS),比每例肺癌组织产生的LCO数量少200倍左右。
为进一步确认肿瘤类器官主要由肿瘤细胞组成,本研究使用了一种LCO特制培养基,其中不含NLS培养所需的生长因子,比如FGF7、FGF10、R-spondin 1和Noggin,结果表明作者的样品处理和培养方法可以产生适合后续药物敏感性测试的LCO。
2. LCO的特征
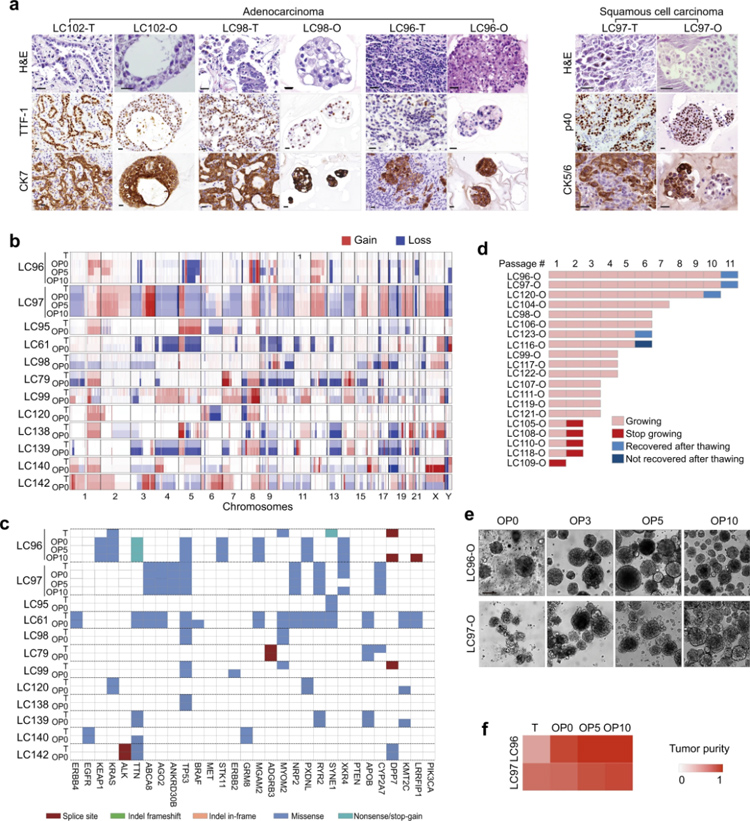
原文图2 肺癌组织及其衍生类器官的HE和免疫组化染色图像
作者对肺癌组织和相应的LCO进行了全基因组测序分析,确定了12组肺癌组织及其对应的肿瘤类器官的基因组特征,发现了LCO保留了原有组织DNA拷贝数的增益和损失,但由于癌细胞的富集,LCO比原始肺癌组织表现出更清晰的信号。作者还发现,在匹配的样本当中,突变负荷和突变类型大多是保守的,而不同患者样本在突变总数和个体特征的相对贡献方面则表现出很高的差异。然后作者将LCO的基因表达谱与匹配的癌组织和正常组织进行比较,发现在LCO中,与细胞粘附分子和免疫反应相关的基因富集,这与类器官培养中缺乏肿瘤微环境相一致。
作者用机械处理方法长期培养了16例AC和4例SCC样本的LCO,培养时长至少超过1个月,他们发现这些LCO的增殖率和扩增能力具有很大的差异。总体来说,机械加工法产生的LCO保留了原始肿瘤的组织学和遗传特征,并可以在体外长期培养和传代后保持稳定,说明原代LCO确实具有肿瘤类器官的主要特征。
3. InSMAR-chip用于药物敏感性测试

原文图3 集成超疏水微孔阵列芯片(InSMAR-chip)的表征
作者开发了一款InSMAR-chip,是一种集成超疏水微孔阵列芯片,可用于培养LCOs并在纳升尺度上测量LCOs对药物的反应,发现了芯片上培养的LCOs的生长速度和活力与在传统微孔板上培养的相似,更重要的是保持了亲代肿瘤组织的三维结构。作者在InSMAR-chip上追踪LCOs的生长,发现LCOs可在InSMAR-chip上持续增长至少3周。
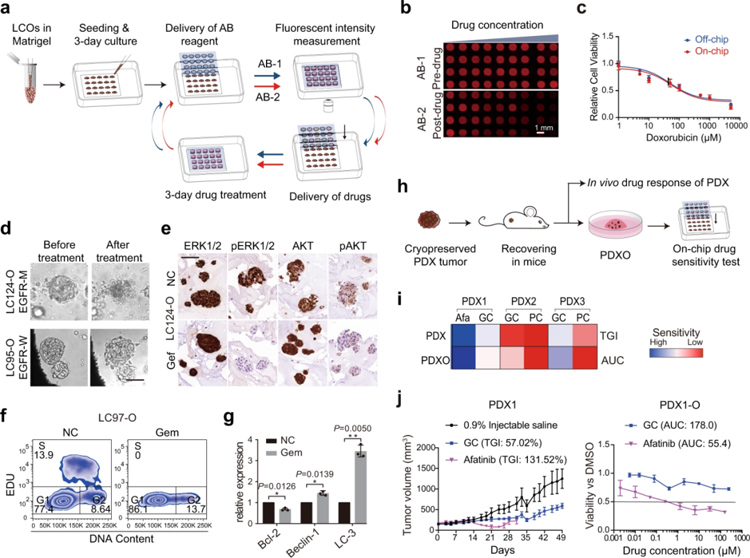
原文图4 InSNAR-芯片上基于类器官的1周药物敏感性测试的验证
接下来作者在InSMAR-chip上进行了6天的药物敏感性测试,在InSMAR-chip和96孔板上进行细胞活力测试,研究表明芯片上测得的药物-反应曲线与96孔板上的曲线完全重合,证明了芯片上细胞活力测量的可靠性。作者也测试了在InSMAR-chip上培养的LCO对靶向药物和化疗药物的应答是否正常,发现了正如预期那样,在LCO的培养基中加入吉西他滨,S期细胞的百分比从处理前的13.9%下降到暴露24小时后的0%,除了细胞周期中断外,吉西他滨处理的细胞还显示抗凋亡基因Bcl2的表达受到抑制,自噬相关基因Beclin-1和LC-3的表达提高。
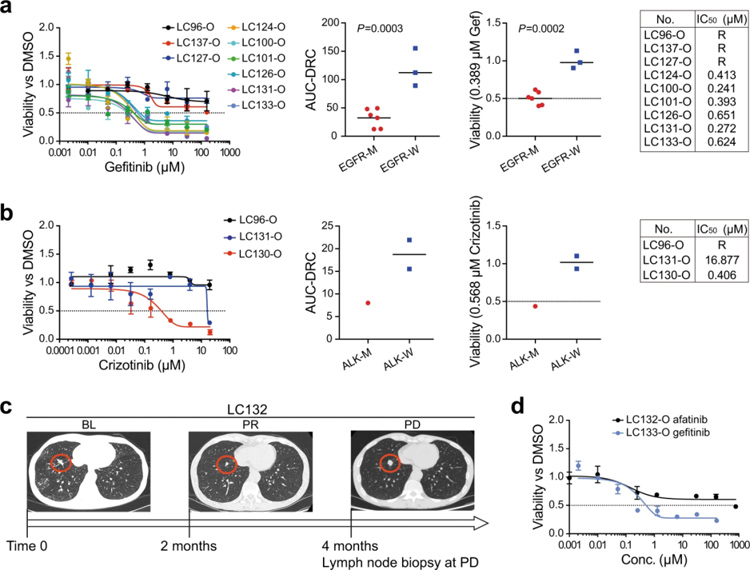
原文图5 基于LCO的1周药敏试验反应了肺癌对靶向药物的应答情况
作者测试了常用抗肺癌药物对来自21个患者样本的类器官的影响,作者首先利用12个样本证明了LCO对靶向治疗的反应与原始肿瘤的基因突变有关,9个LCO来自未接受治疗的患者,其中6个具有对酪氨酸激酶抑制剂敏感的EGFR激活突变,另外3个具有野生型EGFR。因此,本文作者在InSMAR-chip上培养LCO并用吉非替尼(EGFR的靶向药)进行药敏测试,结果显示,有EGFR突变的LCO细胞活率显著下降,而EGFR野生型的LCO则正常增殖,符合预期。研究人员还比较了携带EML4-ALK重排突变的LC130-O和另外两个ALK阴性的LCOs (LC96-O和LC131-O)对另一种靶向药物克唑替尼的反应。结果表明,LC130-O对Cri的敏感性高于其他两种LCO。
这些结果表明,与基因突变相比,一周芯片上检测更能反映肿瘤的获得性耐药。
4. 药敏测试总结了患者对化疗的反应
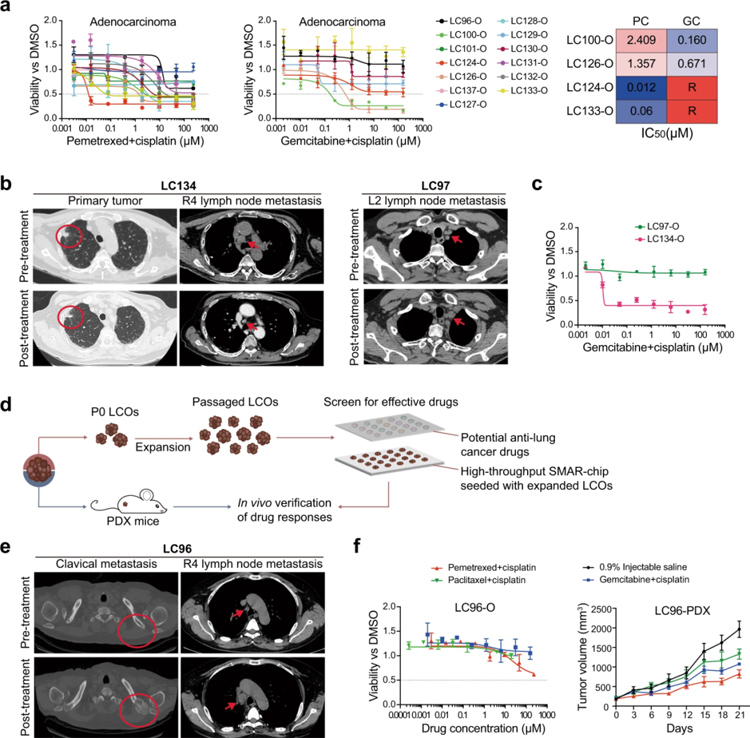
原文图6 一周药敏试验代表肿瘤对化疗的反应异质性
作者将InSMAR-chip上的LCO的药敏结果与临床上相应患者的反应进行比较,发现在吉西他滨+顺铂治疗两个疗程后,在同侧L2淋巴结中发现了一个新的转移灶,表明原始肿瘤对这一治疗方案具有耐药性,而同一患者来源的LCO在InSMAR-chip上的药敏测试结果也证明了该患者对这一治疗方案的耐药性。总的来说,作者在InSMAR-chip上总共对21个类器官进行了药物敏感性测试,评估各个患者的反应,通过芯片分析、测试、给药,一周药物敏感性测试结果与临床数据一致,这些结果证明了为期一周的芯片药物敏感性试验在预测患者治疗反应方面具有很大潜力。
三、编者点评:
虽然患者衍生类器官(PDO)对抗癌治疗的反应已经得到充分认识,但建立PDO时间长且效率低阻碍了药物敏感性测试在临床方面的实施,所以本文作者采用机械样品处理方法,从手术切除和活检的肿瘤组织中构建肺癌类器官(LCO),通过使用集成超疏水性微孔阵列芯片(InSMAR-chip),证明了数百个LCO可以在一周内产生具有临床意义的药物反应,结果表明,作者的一周药物敏感性检测与患者来源的异种移植物、肿瘤基因突变和临床结果保持一致。LCO模型与微孔装置的结合,加快了类器官用于个体化精准医疗的步伐。
作为斑马鱼生物技术的全球领导者,环特生物搭建了“斑马鱼、类器官、哺乳动物、人体”四位一体的综合技术服务体系,开展科研服务、智慧实验室建设和精准医疗三大业务。目前,环特类器官平台已建立肺癌及多种癌种的类器官培养平台,欢迎有需要的读者垂询!
参考资料:
[1] Ferlay, J. et al. Cancer incidence and mortality worldwide: sources, methods and major patterns in GLOBOCAN 2012.Int. J. Cancer136, E359–E386 (2015).
[2]Huang, M., Shen, A., Ding, J. & Geng, M. Molecularly targeted cancer therapy: some lessons from the past decade.Trends Pharmacol. Sci.35, 41–50 (2014).
[3]Hidalgo, M. et al. Patient-derived xenograft models: an emerging platform for translational cancer research.Cancer Discov.4, 998–1013 (2014).
[4]Tuveson, D. & Clevers, H. Cancer modeling meets human organoid technology.Science364, 952–955 (2019).
[5]Granat, L. M. et al. The promises and challenges of patient-derived tumor organoids in drug development and precision oncology.Anim. Model Exp. Med.2, 150–161 (2019).
[6]Lau, H. C. H., Kranenburg, O., Xiao, H. & Yu, J. Organoid models of gastrointestinal cancers in basic and translational research.Nat. Rev. Gastroenterol. Hepatol.17, 203–222 (2020).
[7]Broutier, L. et al. Human primary liver cancer-derived organoid cultures for disease modeling and drug screening.Nat. Med.23, 1424–1435 (2017).
[8]Sachs, N. et al. A living biobank of breast cancer organoids captures disease heterogeneity.Cell172, 373–386 (2018).
[9]Lee, S. H. et al. Tumor evolution and drug response in patient-derived organoid models of bladder cancer.Cell173, 515–528 (2018).
[10]Cohen, M. H., Williams, G. A., Sridhara, R., Chen, G. & Pazdur, R. FDA drug approval summary: gefitinib (ZD1839) (Iressa) tablets.Oncologist8, 303–306 (2003).