
NEWS
新闻中心
SERVERS
服务项目
NEWS
最新资讯
发布时间:2021-09-15

斑马鱼作为发育毒性试验的一种替代动物模型,近年来已经被广泛应用,但其检测方案尚未统一。
9月初, SCI期刊《Frontiers in Cell and Developmental Biology》(JCR分区:发育生物学类1区,IF=6.684)上发表了题为《Validation, Optimization, and Application of the Zebrafish Developmental Toxicity Assay for Pharmaceuticals Under the ICHS5(R3) Guideline》的高分研究论文。
该研究成果由环特生物、浙江省医学科学院(杭州医学院)安全性评价研究中心、浙江省医学科学院(杭州医学院)浙江省药品安全评价与研究重点实验室、浙江工业大学长三角绿色制药协同创新中心共同发表,也是环特生物发表的第99篇研究与研发论文。
该研究在ICH指导原则下,验证并优化了先前由美国和欧洲的多个实验室间研究报告的斑马鱼发育毒性测定,并证实了:斑马鱼作为一种发育毒性与致畸性试验的替代动物模型,可达到90.3%灵敏度(28/31个阳性化合物对具有致畸作用)和 88.9% (40/45) 总体可预测性。这项研究结果充分支持使用斑马鱼作为替代体内方法来筛选和评估候选药物的发育毒性与致畸性以供监管、使用,可用于新药IND人体临床实验申请。
一起来看论文主要内容——
发育毒性与致畸性试验研究概述
发育毒性和致畸性是一个严重的安全问题,大约 5-10% 的人类新生儿先天性异常是由致畸剂引起的。1966 年,沙利度胺的发育影响得到认可后,食品和药物管理局 (FDA) 制定了用于评估药物在批准供人类使用之前对生殖和发育的影响的方案。
此外,目前有超过 143,835 种预先注册的化学品可能污染食品和环境,但这些和其他现有化学品中约有 86% 没有安全测试数据。
出于对化学品安全性的担忧,欧洲化学品注册、评估、授权和限制 (REACH) 计划制定了协议(经济合作与发展组织 (OECD) 指南 TG 414、TG 416 、TG 421和 TG 422),以收集每年生产或销售数量超过 1 吨的所有化学品的此类数据。这种情况促使研究发育毒性测试的替代方法,即全胚胎培养 (WEC) 测试 、哺乳动物微量 (MM) 测试 和胚胎干细胞测试。前两种模型仍然使用完整的哺乳动物作为测试系统,一个一直是有争议的领域。事实上,这些测试并没有涵盖胚胎发育的整个时期。
斑马鱼作为一种非哺乳类脊椎动物,具有多种替代毒性测定的优势,如经济饲养要求、胚胎透明度、高繁殖力和 6-384 孔板高通量筛选等。此外,斑马鱼也是发育毒性测试的适用模型,过去 10 年中实际上已经在斑马鱼中评估了药物和化合物的发育毒性,如表 1(经济合作与发展组织 [经合组织],2011 年;经济合作与发展组织 [经合组织],2012 年)。
表 1. 已发表的通过斑马鱼来评估化合物的发育毒性
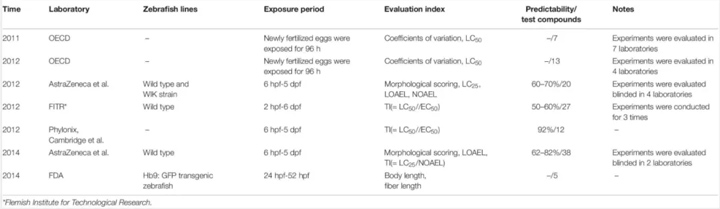
在四个实验室的一项盲法研究中,通过斑马鱼测试了 20 种非专利化合物的发育毒性,每个实验室都实现了与哺乳动物数据相似的整体一致性(60-70%)。在优化实验参数并考虑斑马鱼胚胎摄取后,在该项目的第二阶段,在两个实验室评估了 38 种专有药物化合物,实现了 62-82% 的总一致性。在其他研究中,斑马鱼发育毒性试验在佛兰德技术研究所和 Phylonix 制药公司分别实现了 50-60% 和 92% 的总体预测值。
明显可以看出,这些来自斑马鱼试验的发育毒性报告并不统一:致畸性的定义、结果的可预测性、与实验条件和数据分析相关的多个细节以及浓度设置的合理性都没有得到充分优化和验证。
国际协调会议 (ICH) 协调指南 S5(R3)(国际协调会议 [ICH],2017 年、2020 年)的发布和实施正在推动着中国发育毒性试验替代方法的进步。在中国参与修订的国际协调会议(ICH)S5(R3)第2步指南草案(2017)(国际协调会议[ICH],2017)中引入替代测试系统是大的更新之一,也是头一次在ICH安全性评价指南中大量增加替代试验方法的内容。
ICH 指南建议使用替代体外和非哺乳动物体内生殖试验用于胚胎-胎儿发育毒性 (EFD) 风险评估。ICH S5(R3) 终版本(2020 年)明确指出,从单独进行或与一项或多项体内研究结合进行的合格替代测定所产生的数据可用于支持在有限情况下的危害识别和风险评估。然而,斑马鱼发育毒性试验产生的数据已在国内外用于研究性新药(IND)申请,但尚未得到中国药品监督管理部门的正式认可。
在这项研究中,我们打算在国际上验证和优化初步建立的斑马鱼发育毒性试验作为替代体内试验,并希望得到中国药品监管机构的监管认可。遵循 ICH 参考化合物列表,根据其类别从 66 种化合物中选择了 45 种化合物用于致畸性实验:50 个阳性对照中的 31 个和 16 个阴性对照中的 14 个。
我们已经评估并验证了起初由多个实验室间研究报告的斑马鱼发育毒性测定方案,此处称为“经典方案”。结合我们的经验 和其他研究,我们优化了原始经典方案,并进一步提高了其在 ICH 下药物使用的可预测性S5(R3) 指南。
此外,还应用了三种非 ICH 参考化合物绿原酸、雷公藤内酯和乌头碱来测试斑马鱼发育毒性试验。本研究的结果表明,本报告中优化和验证的斑马鱼发育毒性试验是一种可靠且可重复的非哺乳动物体内方法,用于筛选和评估候选动物的致畸性(即畸形或胚胎-胎儿致死率,MEFL)化合物。
优化斑马鱼发育毒性试验的验证试验
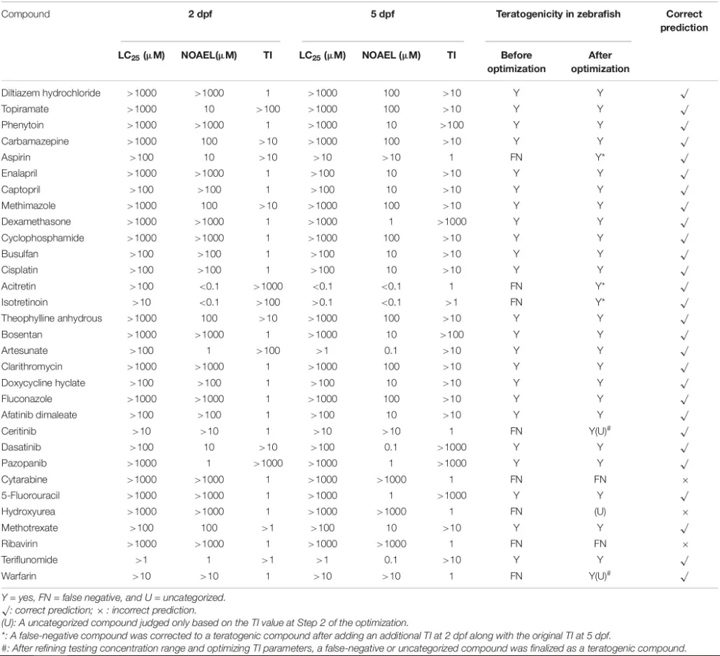
“优化前”,斑马鱼发育毒性实验结果如表2所示,31个ICH阳性化合物中,23个化合物(74.2%)对斑马鱼有致畸作用,8个具有致畸性,假阴性结果;在 14 种 ICH 阴性化合物中,12 种化合物 (85.7%) 在斑马鱼中无致畸性,2 种具有假阳性结果,总体一致性为 77.8% (35/45)。
斑马鱼中阴性对照(非致畸剂)化合物的发育毒性结果共包含 14 个阴性对照,12 种非致畸化合物对斑马鱼的影响与 ICH 分类高度一致,但盐酸赛庚啶和盐酸环苯扎林被 ICH 归类为阴性对照,但呈现为假-斑马鱼测试的阳性结果。
Cyproheptadine hydrochloride 产生显着的致畸表型,包括心包水肿、心动过缓、血流缺失、下巴过大、眼睛小、肝变性、卵黄囊吸收延迟、肾水肿和鱼鳔丢失,浓度为 10 μM,斑马鱼死亡 25% 100 和 1000 μM 时 100% 死亡。盐酸环苯扎林在 100 μM 时诱导明显的肝变性和下颌过大,在 1000 μM 时有 8.3% 的死亡和 100% 的死亡。
表 2. 斑马鱼阳性对照(致畸剂)化合物的发育毒性结果
在起初的经典协议中,斑马鱼的发育毒性仅在 5 dpf 时进行评估,从而导致更高的假阴性结果。我们在研究中发现,在 2 dpf 和 5 dpf 评估的斑马鱼发育毒性可以为阳性致畸化合物提供更好的可预测性。
为了验证优化的斑马鱼发育毒性测定,使用新的协议和标准在斑马鱼中测试了三种非 ICH 化合物。如表 3所示,在 2 dpf 时,在 0.1 μM 雷公藤内酯处理的斑马鱼中未观察到与化合物相关的毒性表型和死亡,但 12 条斑马鱼在 1 μM 时出现心包水肿,12 条斑马鱼在 10 时死亡微米。在 5 dpf 时,0.1 μM 雷公藤内酯处理导致 12 条斑马鱼肾水肿、心包水肿和心血管毒性,1 μM 时 3 条斑马鱼死亡,9 条斑马鱼出现畸形。因此,LC 25为 1 μM,NOAEL <0.1 μM。
表 3.优化斑马鱼发育毒性试验对雷公藤内酯、乌头碱和绿原酸的应用
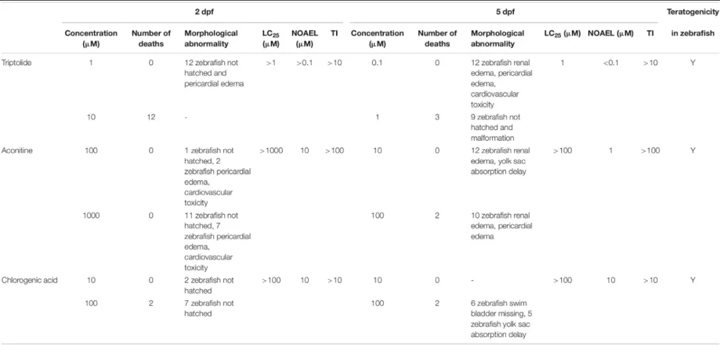
在 2 dpf 斑马鱼中,乌头碱在 2 条斑马鱼中诱导了心包水肿、心血管毒性,并且在 100 μM 下没有死亡,但在 10 μM 下没有与化合物相关的发育不良;在 7 条斑马鱼中,心包水肿、心血管毒性和 1000 μM 无死亡。LC 25 > 1000 μM,NOAEL 为10 μM。在 5 dpf,10 μM 乌头碱处理导致 12 条斑马鱼出现肾水肿和卵黄囊吸收延迟;在 100 μM 时,2 条斑马鱼死亡,10 条斑马鱼出现肾水肿和心包水肿,LC 25 > 100 μM,NOAEL 为 1 μM。
在 2 dpf 斑马鱼中,绿原酸处理未发现与化合物相关的毒性,10 μM 时观察到死亡;在 100 μM 时,两条斑马鱼死亡,但未观察到其他发育不良,LC 25 > 100 μM,NOAEL 为 10 μM。在 5 dpf 时,在 10 μM 时未检测到毒性;100 μM,2条斑马鱼死亡,6条斑马鱼鱼鳔丢失,5条斑马鱼卵黄囊吸收延迟,LC 25 >100 μM,NOAEL为10 μM。雷公藤内酯、乌头碱和绿原酸的 TI 值分别 >10、>100 和 >10,这三种化合物均被归类为斑马鱼的致畸剂。这些结果通过图 1所示的精细浓度测试得到了进一步证实。
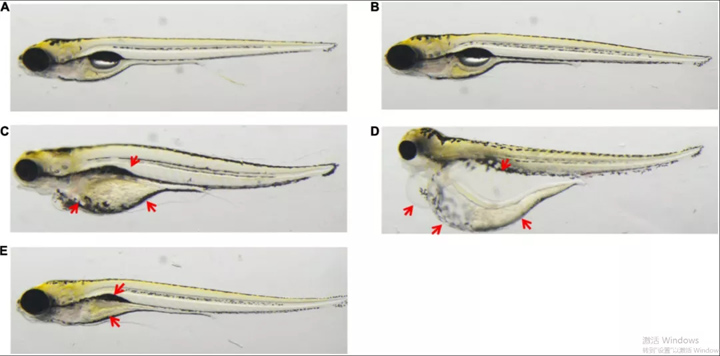
图 1.应用:雷公藤内酯、乌头碱、绿原酸,对 5 dpf 的斑马鱼进行处理。(A)未经处理。(B) 0.5% DMSO。(C) 0.1 μM 雷公藤内酯治疗导致斑马鱼肾水肿、心包水肿和心血管毒性。(D) 100 μM 的乌头碱处理导致斑马鱼出现肾水肿和心包水肿。(E) 100 μM 的绿原酸处理导致斑马鱼出现鳔丢失和卵黄囊吸收延迟。
总结
斑马鱼具有与哺乳动物相似的生理、形态和功能,被认为是评估候选药物和化学品毒性和安全性的有价值的体内模型。近年来,美国和欧洲多个实验室报道的斑马鱼发育毒性试验和斑马鱼胚胎毒性试验的实验方法、参数和预测灵敏度不一致(表1))。
大多数斑马鱼发育毒性试验需要将斑马鱼胚胎暴露于高达 5 dpf 以进行生存能力和形态学评估。根据欧盟关于保护实验动物的指令,独立饲养是斑马鱼胚胎接受动物实验规定的阶段。通常,孵化后的胚胎 > 5 dpf 被认为是受保护的,因为鱼鳔已膨胀,可以自由游泳和自我进食。因此,整个生物体检测的设计符合与使用非受保护物种相关的定义。
参考国际上报道的斑马鱼发育毒性和致畸性评价方法,我们拟验证和优化一种快速可靠的替代方法,有望在中国和世界范围内用于IND监管。该方法通量高,节省新药研发时间和成本。
经过优化,斑马鱼发育毒性测定灵敏度从 74.2% (23/31) 提高到 90.3% (28/31),整体一致性从 77.8% (35/45) 提高到 88.9% (40/45) 。根据 ECVAM(欧洲替代方法验证中心)评估新检测预测值的标准,该检测被评为优秀 (>85%)用于鉴定发育毒性和致畸化合物。
正如 ICH S5(R3) 所指出的,使用合格的替代试验,例如非哺乳动物体内试验,可以减少动物的使用,同时保持检测相关生殖风险的能力,并且在某些情况下可以成为风险评估的合适方法。此外,作为综合测试策略的一部分,使用合格的替代检测可能是推迟体内测试的潜在方法。
这项研究结果,充分支持斑马鱼发育毒性试验作为体内可预测的非哺乳动物筛选和评估候选化合物的致畸性的方法,而这种斑马鱼试验可能是监管认可的有前途的替代测试系统。
参考文献:
[1] Ball, J. S., Stedman, D. B., Hillegass, J. M., Zhang, C. X., Panzica-Kelly, J., Coburn,A., et al. (2014). Fishing for teratogens: a consortium effffort for a harmonizedzebrafifish developmental toxicology assay. Toxicol. Sci. 139, 210–219. doi: 10.1093/toxsci/kfu017
[2] Belanger, S. E., Balon, E. K., and Rawlings, J. M. (2010). Saltatory ontogeny of fifishesand sensitive early life stages for ecotoxicology tests. Aquat. Toxicol. 97, 88–95.doi: 10.1016/j.aquatox.2009.11.020
[3 ]Brannen, K. C., Panzica-Kelly, J. M., Danberry, T. L., and Augustine-Rauch,K. A. (2010). Development of a zebrafifish embryo teratogenicity assay andquantitative prediction model. Birth Defects Res. B. Dev. Reprod. Toxicol. 89,66–77. doi: 10.1002/bdrb.20223
[4] Dooley, K., and Zon, L. I. (2000). Zebrafifish: a model system for the study of humandisease. Curr. Opin. Genet. Dev. 10, 252–256. doi: 10.1016/s0959-437x(00)00074-5Fleischer, M. (2007). Testing costs and